题目内容
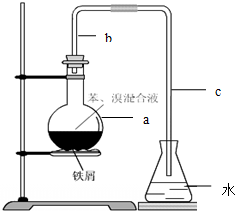
中学实验常用如图所示装置制取少量溴苯.在烧瓶a中装的试剂是苯、溴和铁粉.请填写下列空白.
(1)导管b的作用有两个:一是导气,二是兼起
(2)a中反应的化学方程式为 +Br2
+Br2
 +HBr
+HBr +Br2
+Br2
 +HBr;
+HBr;
(3)该实验得到的是粗苯,为了除去其中的溴,要用到的一种常用除杂操作方法是
A.①②③④⑤B.②④⑤③①C.④②③①⑤D.②④①⑤③
(4)为证明苯和溴发生的是取代反应而不是加成反应,可向水中加入

(1)导管b的作用有两个:一是导气,二是兼起
冷凝回流
冷凝回流
的作用;(2)a中反应的化学方程式为
 +Br2
+Br2| Fe |
 +HBr
+HBr +Br2
+Br2| Fe |
 +HBr
+HBr(3)该实验得到的是粗苯,为了除去其中的溴,要用到的一种常用除杂操作方法是
分液
分液
,提纯溴苯的具体步骤有:①蒸馏;②水洗;③用干燥剂干燥;④10%NaOH溶液洗;⑤水洗.正确的操作顺序为B
B
A.①②③④⑤B.②④⑤③①C.④②③①⑤D.②④①⑤③
(4)为证明苯和溴发生的是取代反应而不是加成反应,可向水中加入
AgNO3溶液(或紫色石蕊试液)
AgNO3溶液(或紫色石蕊试液)
;但该实验不够严密,为此必须在导管a、b之间加上一盛有CCl4(或苯)
CCl4(或苯)
的洗气瓶,目的是除去HBr气体中的溴蒸汽.
除去HBr气体中的溴蒸汽.
.分析:(1)苯和溴易挥发;
(2)苯和液溴在铁粉催化作用下发生取代反应生成溴苯和溴化氫:C6H6+Br2
C6H5Br+HBr;
(3)溴苯与溶液不互溶,利用分液分离除杂;根据实验原理分析步骤的排序;
(4)溴化氫易溶于水电离出H+和Br-,通过检验H+和Br-证明;由于反应放热,苯和液溴均易挥发,溴的存在干扰验H+和Br-.
(2)苯和液溴在铁粉催化作用下发生取代反应生成溴苯和溴化氫:C6H6+Br2
| Fe |
(3)溴苯与溶液不互溶,利用分液分离除杂;根据实验原理分析步骤的排序;
(4)溴化氫易溶于水电离出H+和Br-,通过检验H+和Br-证明;由于反应放热,苯和液溴均易挥发,溴的存在干扰验H+和Br-.
解答:解:(1)苯和溴易挥发,导管b除导气外,还有起冷凝回流作用,减少苯和溴易挥发,故答案为:冷凝回流;
(2)在催化剂的作用下,苯环上的氢原子被溴原子所取代,生成溴苯,同时有溴化氢生成,反应方程式为 +Br2
+Br2
 +HBr,
+HBr,
故答案为: +Br2
+Br2
 +HBr;
+HBr;
(3)溴苯与溶液不互溶,利用分液分离提纯;除去粗苯中的溴,具体原理为开始水洗除FeBr3、Br2;碱洗主要除多余的Br2;水洗除NaOH;干燥除水;蒸馏除去苯,所以顺序为②④⑤③①,故答案为:分液;B;
(4)如果发生取代反应,生成溴化氢,溴化氫易溶于水电离出H+和Br-,只要检验含有氢离子或溴离子即可.
溴离子的检验:取溶液滴加硝酸银溶液,如果生成淡黄色沉淀就证明是溴离子;
氢离子的检验:如果能使紫色石蕊试液变红,就证明含有氢离子.
由于反应放热,苯和液溴均易挥发,溴的存在干扰检验H+和Br-,所以必须在导管a、b之间加上洗气瓶,除去溴化氢气体中的溴蒸气,溴极易溶于四氯化碳或苯等有机溶剂,洗气瓶中盛放四氯化碳或苯即可.
故答案为:AgNO3溶液或紫色石蕊试液;四氯化碳或苯;除去溴化氢气体中的溴蒸气.
(2)在催化剂的作用下,苯环上的氢原子被溴原子所取代,生成溴苯,同时有溴化氢生成,反应方程式为
 +Br2
+Br2| Fe |
 +HBr,
+HBr,故答案为:
 +Br2
+Br2| Fe |
 +HBr;
+HBr;(3)溴苯与溶液不互溶,利用分液分离提纯;除去粗苯中的溴,具体原理为开始水洗除FeBr3、Br2;碱洗主要除多余的Br2;水洗除NaOH;干燥除水;蒸馏除去苯,所以顺序为②④⑤③①,故答案为:分液;B;
(4)如果发生取代反应,生成溴化氢,溴化氫易溶于水电离出H+和Br-,只要检验含有氢离子或溴离子即可.
溴离子的检验:取溶液滴加硝酸银溶液,如果生成淡黄色沉淀就证明是溴离子;
氢离子的检验:如果能使紫色石蕊试液变红,就证明含有氢离子.
由于反应放热,苯和液溴均易挥发,溴的存在干扰检验H+和Br-,所以必须在导管a、b之间加上洗气瓶,除去溴化氢气体中的溴蒸气,溴极易溶于四氯化碳或苯等有机溶剂,洗气瓶中盛放四氯化碳或苯即可.
故答案为:AgNO3溶液或紫色石蕊试液;四氯化碳或苯;除去溴化氢气体中的溴蒸气.
点评:本题以苯的性质及离子的检验为载体,考查学生的思维分析能力、实验设计能力等,是对知识的综合运用,理清实验原理是解答的关键.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案
相关题目
(14分)中学实验常用如图所示装置制取少量溴苯。在烧瓶a中装的试剂是苯、溴和铁粉。请填写下列空白。
⑴导管b的作用有两个:一是导气,二是兼起 的作用;
⑵a中反应的化学方程式为 ;
⑶该实验得到的是粗苯,为了除去其中的溴,要用到的一种常用除杂操作方法是 ,提纯溴苯的具体步骤有:
①蒸馏;②水洗;③用干燥剂干燥;④10%NaOH溶液洗;⑤水洗 。
正确的操作顺序为( )
| A.①②③④⑤ | B.②④⑤③① | C.④②③①⑤ | D.②④①⑤③ |