题目内容
【题目】汽车尾气中的CO和NO在排放时会发生复杂的化学反应。回答下列问题:
(1)通过NO传感器可监测汽车排放尾气中NO含量, 其工作原理如图所示。
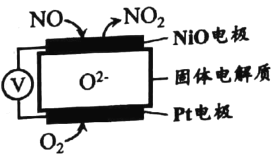
该传感器正极的电极反应式为 _________________。
(2)已知如下发生反应:
①2CO(g)+O2(g)=2CO2(g) △H1 =-606.6 kJ·mol-1
②2NO(g)+O2(g)=2NO2(g) △H2= -114.1 kJ·mo l-1
则反应CO(g) +NO2(g) = CO2(g) +NO(g)的△H =__________kJmo l-1
(3)300K时,将等浓度的CO 和 NO2混合加入刚性密闭容器中,发生反应CO(g) +NO2(g) = CO2(g) +NO(g), 测得 c(CO)浓度随时间t 的变化如表所示。
t/min | 0 | 20 | 90 | 170 | 560 | 1600 | 13200 | 14000 | ∞ |
c(CO)/mol·L-1 | 0.100 | 0.075 | 0.055 | 0.047 | 0.034 | 0.025 | 0.013 | 0.013 | 0.013 |
①300K时反应的平衡转化率α=_______%。平衡常数K=_______(保留1 位小数)。
②在300K下: 要提高CO转化率, 可采取的措施是_____________;要缩短反应达到平衡的时间,可采取的措施有______________、____________________。
③实验测得:反应物浓度按任意比时,该反应的正反应速率均符合v正=k正c2(NO2)。其中:k正为正反应速率常数,是与平衡常数K类似的只受温度影响的常数。请推理出v逆的表达式:v逆=_____________ (用k正 、 K 与c(CO)、c(CO2 )、c(NO)表达)。
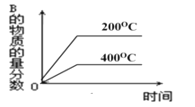
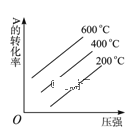
④根据v逆的表达式 ,一定温度下,当反应达平衡后, t1时刻增大CO浓度, 平衡发生移动,下列图像正确的是______________。
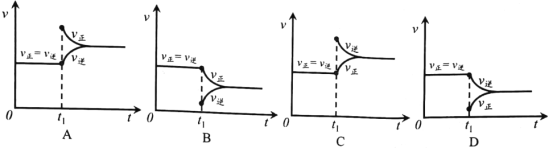
【答案】O2+4e-===2O2- -246.25 87 44.8 及时移走产物 选用更高效的催化剂 提高反应物压强(浓度) ![]() B
B
【解析】
(1)首先这个装置没有外电源,因此是一个原电池装置,按照原电池的规律来分析即可;
(2)这是一道典型的盖斯定律应用,只需用①式减去②式,再将化学计量数化为最简整数比即可得到答案;
(3)观察表格,可以发现在13200min后反应物的浓度不再改变,此时的浓度就是平衡浓度,再根据平衡浓度来计算转化率、平衡常数即可。
(1)根据分析,这是一个原电池,正极氧气得电子变成![]() ,电极反应为
,电极反应为![]() ;
;
(2)用①式减去②式可以得到![]() ,再整体除以2即可得到答案;
,再整体除以2即可得到答案;
(3)①转化率![]() ,四种物质的化学计量数均为1,因此平衡时反应物的浓度均为
,四种物质的化学计量数均为1,因此平衡时反应物的浓度均为![]() ,生成物的浓度均为
,生成物的浓度均为![]() ,则
,则![]() ;
;
②温度给定的情况下,我们可以通过及时移走产物的方式,来提高原料的转化率;而要缩短反应时间,可以通过选择更高效的催化剂,或者提高反应物的浓度来实现;
③当![]() 时,反应达到平衡状态,即此时
时,反应达到平衡状态,即此时![]() ,代入平衡常数的表达式,化简可得
,代入平衡常数的表达式,化简可得![]() ;
;
④![]() 和
和![]() 的表达式我们已经有了,增大
的表达式我们已经有了,增大![]() 的浓度对
的浓度对![]() 无影响,但会使
无影响,但会使![]() 降低,符合事实的图像为B,答案选B。
降低,符合事实的图像为B,答案选B。

 全优点练单元计划系列答案
全优点练单元计划系列答案