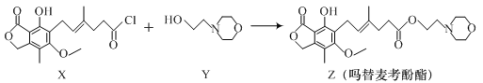
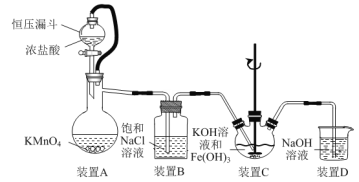
题目内容
【题目】乙醛能够发生下列反应:
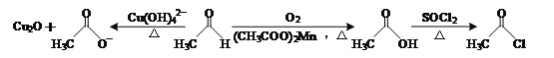
(1)Mn2+的基态电子排布式为____。
(2)氯化亚砜(SOCl2)是有机合成中重要的氯化剂,与SOCl2互为等电子体的阴离子的化学式为____。
(3)CH3CHO分子中碳原子的轨道杂化类型是____。
(4)乙酸的沸点(117.9 ℃)比乙醛的沸点(20.8 ℃)高的主要原因是____。
(5)不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为____。
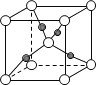
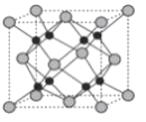
(6)如图表示Cu2O的晶胞,Cu+的配位数是____。
【答案】[Ar]3d5 SO32-或ClO3- sp3和sp2 乙酸分子间存在氢键,乙醛分子间不存在氢键 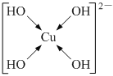 或
或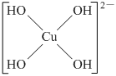 2
2
【解析】
(1)根据Mn的核外电子排布式判断基态Mn2+的核外电子排布式;
(2)等电子体是指价电子数和原子数(氢等轻原子不计在内)相同的分子、离子或原子团;
(3)根据价层电子及孤对电子数进行判断;
(4)乙酸分子间存在氢键,乙醛分子间不存在氢键;
(5) 根据配合物中配位键提供孤电子对的原子指向提供空轨道的原子等分析;
(6)根据均摊法进行计算。
(1)Mn的电子排布式为[Ar]3d54s2,则基态Mn2+的核外电子排布式为[Ar]3d5;
(2)等电子体是指价电子数和原子数都相同的分子、离子或原子团;与SOCl2互为等电子体的阴离子的化学式为SO32-或ClO3-;
(3)CH3CHO中全部以单键连接C原子的价层电子对数为4,属于sp3杂化,存在C=O中的C原子的价层电子对数为3,属于sp2杂化,所以C原子有2中杂化类型;
答案为sp3和sp2;
(4)乙酸的沸点(117.9 ℃)比乙醛的沸点(20.8 ℃)高的主要原因是乙酸分子间存在氢键,乙醛分子间不存在氢键;
(5) [Cu(OH)4]2-配合物中,铜原子提供空轨道,OH-中氧原子提供孤电子对,Cu2+与4个OH-形成配位键,配位键由提供孤电子对的原子指向提供空轨道的原子,所以其表示方法为: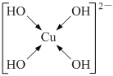 或
或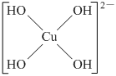 ;
;
(6)○为1+8×![]() =2,
=2,![]() 为4个。所以
为4个。所以![]() 代表Cu原子,○代表氧原子。一个Cu原子周围有2个O原子,所以其配位数为2。
代表Cu原子,○代表氧原子。一个Cu原子周围有2个O原子,所以其配位数为2。

【题目】X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
元素 | 相关信息 |
X | X原子的L层电子数是K层电子数的2倍 |
Y | Y原子的最外层电子排布式为:nsnnpn+2 |
Z | Z存在质量数为23,中子数为12的原子核 |
W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(1)W位于元素周期表第_____周期第______族,其原子最外层有____个电子。
(2)X的活泼性比Y的_____(填“强”或“弱”);X和Y的气态氢化物中,较稳定的是____(写化学式)。
(3)写出Z2Y2的电子式________________,XY2的结构式__________________。
(4)在X原子与氢原子形成的多种分子中,有些分子的核磁共振氢谱显示有两种氢,写出其中一种分子的名称______________。氢元素、X、Y的原子也可共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式________________。
【题目】(1)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g)△H=-92.4 kJ/mol,其化学平衡常数K与温度t的关系如下表:
2NH3(g)△H=-92.4 kJ/mol,其化学平衡常数K与温度t的关系如下表:
t/K | 298 | 398 | 498 | ...... |
K/(mol/L)2 | 4.1×106 | K1 | K2 | ...... |
完成下列问题:
①比较K1、K2的大小:K1_______K2(填“>”、“=”或“<”);
②在恒温恒压下判断该反应达到化学平衡状态的依据是_______(填序号);
A 2v(H2)(正)=3v(NH3)(逆)
B 2v(N2)(正)=v(H2)(逆)
C 容器内压强保持不变
D 混合气体的密度保持不变
(2)工业上生产尿素的化学方程式为:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6molNH3和3molCO2,反应达到平衡时,c(NH3)=0.5mol·L-1,则该反应的平衡常数K=_______。若此时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入3molNH3,则此时反应的v正_______v逆(填“>”“<”或“=”)。
CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6molNH3和3molCO2,反应达到平衡时,c(NH3)=0.5mol·L-1,则该反应的平衡常数K=_______。若此时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入3molNH3,则此时反应的v正_______v逆(填“>”“<”或“=”)。
(3)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图所示。
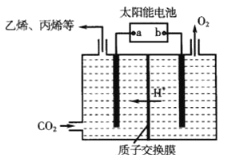
①该工艺中能量转化方式主要有_______。
②电解时,生成乙烯的电极反应式是_______。