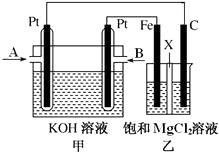
题目内容
【题目】氨是重要的氮肥,合成原理为:N2(g)+3H2(g) ![]() 2NH3(g)△H=﹣92.4kJ/mol.回答下列问题:
2NH3(g)△H=﹣92.4kJ/mol.回答下列问题:
(1)写出平衡常数K的表达式 , 如果降低温度,该反应K值 , 化学反应速率 , N2的转化率(填“增大”、“减小”或“不变”).
(2)在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各种物质的量变化如图所示,回答下列问题: 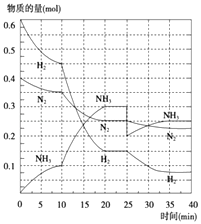
①10min内以NH3表示的平均反应速率: .
②在10~20min内,NH3浓度变化的原因可能是
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加NH3物质的量
③第1次达到平衡的时间为: , 第2次达到平衡的时间为:;
④在反应进行至25min时,曲线发生变化的原因
A.缩小容器体积 B.降低温度 C.分离了部分NH3
达第二次平衡时,新平衡的平衡常数K2K1 ,
(填“大于”、“小于”或“等于”).
【答案】
(1)![]() ;增大;减小;增大
;增大;减小;增大
(2)0.005mol/(L.min);B;10min;20min;C;等于
【解析】解:(1)化学平衡常数K= ![]() ;该反应是一个反应前后气体体积减小的放热反应,降低温度平衡正向移动,化学平衡常数增大,降低温度活化分子百分数减小导致化学反应速率减小,氮气转化率增大,所以答案是:
;该反应是一个反应前后气体体积减小的放热反应,降低温度平衡正向移动,化学平衡常数增大,降低温度活化分子百分数减小导致化学反应速率减小,氮气转化率增大,所以答案是: ![]() ;增大;减小;增大;(2)①10min内以v(NH3)=
;增大;减小;增大;(2)①10min内以v(NH3)= ![]() =
= ![]() mol/(L.min)=0.005mol/(L.min),
mol/(L.min)=0.005mol/(L.min),
所以答案是:0.005mol/(L.min);②在10~20min内,根据图知,改变条件时各物质浓度不变且平衡正向移动,相同时间内改变的物质的量增大,说明反应速率增大,则改变的条件是缩小容器体积,故选B;③反应达到平衡状态时各物质的物质的量不变,根据图知,第一次达到平衡时间为10min,第二次达到平衡时间为20min,
所以答案是:10min;20min;④在反应进行至25min时,氨气物质的量减小、氮气和氢气物质的量不变,所以改变条件是分离出部分氨气;
该反应中温度越高,化学平衡常数越小,温度相同则化学平衡常数相等,所以达第二次平衡时,新平衡的平衡常数K2等于K1 , 所以答案是:C;等于.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】Ⅰ.实验室可以用KMnO4与浓 HCl反应制备氯气,请写出该反应的化学方程式________________,在反应中HCl表现了哪些性质______________________________。
Ⅱ.下图是实验室制氯气并进行一系列相关实验的部分装置(夹持设备已略)。
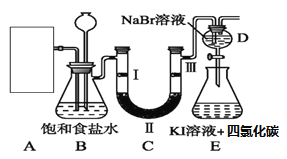
(1)制备氯气选用的药品为漂白粉固体和浓盐酸,反应条件为加热,则反应的化学反应方程式为 _____________________________________。
(2)在该实验中,A部分的装置是_______(填字母)。
(3)装置B中饱和食盐水的作用是_________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象_________。
(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入_____。(填选项字母)
a | b | c | d | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(5)设计装置D、E的目的是比较氯、溴、碘单质的氧化性。当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为__色,说明氯气的氧化性大于溴的,此时反应的离子方程式为_______________。
(6)打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是___________________,得到的结论是 ________ ,反应的离子方程式为__________ 。
(7)有人认为该实验存在明显的缺陷,请你将认为缺少的部分在上图中的相应位置画出,并在添加的装置中标明需要放入的最合适的化学试剂___________。请你写出Cl2与 “最合适的化学试剂”反应的离子方程式____________________________________________。
Ⅲ.报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)_______________________________。