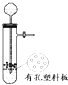题目内容
【题目】Ⅰ.实验室可以用KMnO4与浓 HCl反应制备氯气,请写出该反应的化学方程式________________,在反应中HCl表现了哪些性质______________________________。
Ⅱ.下图是实验室制氯气并进行一系列相关实验的部分装置(夹持设备已略)。
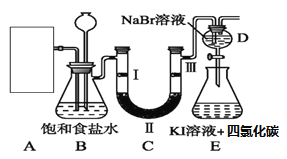
(1)制备氯气选用的药品为漂白粉固体和浓盐酸,反应条件为加热,则反应的化学反应方程式为 _____________________________________。
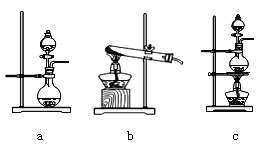
(2)在该实验中,A部分的装置是_______(填字母)。
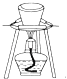
(3)装置B中饱和食盐水的作用是_________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象_________。
(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入_____。(填选项字母)
a | b | c | d | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
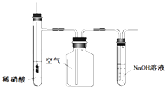
(5)设计装置D、E的目的是比较氯、溴、碘单质的氧化性。当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为__色,说明氯气的氧化性大于溴的,此时反应的离子方程式为_______________。
(6)打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是___________________,得到的结论是 ________ ,反应的离子方程式为__________ 。
(7)有人认为该实验存在明显的缺陷,请你将认为缺少的部分在上图中的相应位置画出,并在添加的装置中标明需要放入的最合适的化学试剂___________。请你写出Cl2与 “最合适的化学试剂”反应的离子方程式____________________________________________。
Ⅲ.报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)_______________________________。
【答案】 2KMnO4+16HCl==2MnCl2+5Cl2↑+2KCl+8H2O 酸性和还原性 Ca(ClO)2+4HCl(浓)![]() CaCl2+2Cl2↑+2H2O c 除去Cl2中的HCl B中长颈漏斗内液面上升,形成水柱 d 橙黄 2Br- + Cl2 = Br2 + 2Cl- E中溶液分为两层,下层(四氯化碳层)为紫红色 溴的氧化性大于碘 Br2+2I-=I2+2Br-
CaCl2+2Cl2↑+2H2O c 除去Cl2中的HCl B中长颈漏斗内液面上升,形成水柱 d 橙黄 2Br- + Cl2 = Br2 + 2Cl- E中溶液分为两层,下层(四氯化碳层)为紫红色 溴的氧化性大于碘 Br2+2I-=I2+2Br- 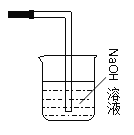 Cl2+2OH-=Cl-+ClO-+H2O Cl-+ClO-+2H+ == Cl2↑+H2O
Cl2+2OH-=Cl-+ClO-+H2O Cl-+ClO-+2H+ == Cl2↑+H2O
【解析】Ⅰ.(1)高锰酸钾与浓盐酸反应生成氯化锰、氯气、氯化钾与水,反应方程式为2KMnO4+16HCl==2MnCl2+5Cl2↑+2KCl+8H2O,反应中盐酸中的氯元素化合价部分升高,被氧化,部分没有变化,体现了盐酸的酸性和还原性,故答案为:2KMnO4+16HCl==2MnCl2+5Cl2↑+2KCl+8H2O;酸性和还原性;
Ⅱ. (1)次氯酸钙与浓盐酸在加热时反应生成氯化钙、氯气与水,反应方程式为Ca(ClO)2+4HCl(浓) ![]() CaCl2+2Cl2↑+2H2O,故答案为:Ca(ClO)2+4HCl(浓)
CaCl2+2Cl2↑+2H2O,故答案为:Ca(ClO)2+4HCl(浓) ![]() CaCl2+2Cl2↑+2H2O;
CaCl2+2Cl2↑+2H2O;
(2)根据题意,次氯酸钙与浓盐酸在加热时反应生成氯气,其中浓盐酸为液体,次氯酸钙为固体,反应条件为加热,故选装置c,故答案为:c;
(3)盐酸易挥发,反应制取的氯气中含有氯化氢,装置B中饱和食盐水的作用是除去Cl2中的HCl;装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,发生堵塞时B中的,压强增大,B中长颈漏斗中液面上升,形成水柱,故答案为:除去Cl2中的HCl;B中长颈漏斗中液面上升,形成水柱;
(4)装置C的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,选项中abc的Ⅱ中都是干燥剂,再通入湿润的有色布条不能验证氯气的漂白性,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,所以选d,故答案为:d;
(5)D中是溴化钠,当向D中缓缓通入少量氯气时,氯气和溴化钠反应生成溴单质,溴水为橙黄色,反应的离子方程式为:2Br-+Cl2=Br2+2Cl-;故答案为:橙黄;2Br-+Cl2=Br2+2Cl-;
(6)打开活塞,将装置D中含溴单质的少量溶液加入焓碘化钾和四氯化碳的装置E中,溴单质和碘化钾反应生成碘单质,碘单质溶于四氯化碳呈紫红色,振荡,观察到的现象是:E中溶液分为两层,下层(四氯化碳层)为紫红色,反应的离子方程式为Br2+2I-=I2+2Br-,说明溴的氧化性大于碘,故答案为:E中溶液分为两层,下层(四氯化碳层)为紫红色;溴的氧化性大于碘;Br2+2I-=I2+2Br-
(7)氯气有毒不能直接排放到空气中,应进行尾气处理,实验室常用氢氧化钠溶液吸收过量的氯气,装置图为 ;反应的离子方程式为;Cl2+2OH-=Cl-+ClO-+H2O;故答案为:
;反应的离子方程式为;Cl2+2OH-=Cl-+ClO-+H2O;故答案为: ;Cl2+2OH-=Cl-+ClO-+H2O;
;Cl2+2OH-=Cl-+ClO-+H2O;
Ⅲ. 次氯酸根离子在酸性条件下氧化氯离子生成氯气和水,离子方程式:Cl-+ClO-+2H+=Cl2↑+H2O,故答案为:Cl-+ClO-+2H+=Cl2↑+H2O。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案