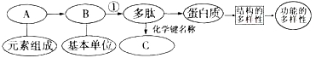
��Ŀ����
����Ŀ������(1)������������ˮ��������ˮ��Ӧ�Ļ�ѧ����ʽΪ_____________________��
��ˮ�Լ��Ե�ԭ����_____________________________ (�����ӷ���ʽ��ʾ)��
(2)��6��0.01 mol��L��1�İ�ˮ�зֱ�����������ʣ�
A��Ũ��ˮ�� B����ˮ�� C������Ũ���ᡡ D������NaOH���塡 E������Al2(SO4)3����
����ʹc(OH��)���١�c(NH4+)�������____(����ĸ����ͬ)��
����ʹc(OH��)����c(NH4+)���ٵ���____��
����ʹc(OH��)��c(NH4+)���������____��
����ʹc(OH��)��c(NH4+)�����ٵ���____��
����ij�¶��´�ˮ��c(H��)��2��10��7 mol��L��1�����ʱc(OH��)��________�����¶�����ˮ�м�����ʹc(H��)��5��10��6 mol��L��1�����ʱc(OH��)��______________________________��
���𰸡� NH3��H2O![]() NH3��H2O NH3��H2O
NH3��H2O NH3��H2O![]() NH4+��OH�� CE D A B 2��10��7 mol��L��1 8��10��9 mol��L��1
NH4+��OH�� CE D A B 2��10��7 mol��L��1 8��10��9 mol��L��1
������������(1)��������ˮ��������ˮ��Ӧ����һˮ�ϰ���һˮ�ϰ����ȶ��ֽ⣬�ʷ���ʽΪ��NH3��H2O![]() NH3��H2O����ˮΪ����ܵ����OH����������Һ�ʼ��ԣ����ӷ���ʽΪ��NH3��H2O
NH3��H2O����ˮΪ����ܵ����OH����������Һ�ʼ��ԣ����ӷ���ʽΪ��NH3��H2O![]() NH4+��OH��
NH4+��OH��
(2) �� �������������������백ˮ����������������ӽ�ϳ�ˮ���ӣ�ʹ����������Ũ�ȼ�С����ˮ��ƽ�������ƶ���NH4+Ũ������ Al3+�ܽ�ϰ�ˮ�������OH-����Al(OH)3������OH��Ũ�ȼ�С����ʹ��ˮ����ƽ�������ƶ���NH4+Ũ������ ���ʴ�ΪC��E�� �� ����NaOH���壬����ˮ�����OH����OH��Ũ������ ��ʹ��ˮ�ĵ���ƽ�������ƶ���NH4+Ũ�ȼ�С����ΪD�� �� ����Ũ��ˮ����ͬʱ�����OH����NH4+��ʹ���ߵ�Ũ�Ⱦ�����ΪA�� ���Ӵ�ˮ�൱��ϡ����OH����NH4+Ũ�Ⱦ���С����ΪB��
������ˮ�У�ˮ�������H+��OH��Ũ��ʼ����ȣ�����c(OH��)��2��10��7 mol��L��1�����¶���ˮ�����ӻ�����Kw=2��10��7��2��10��7=4��10-14, ������ʹc(H��)��5��10��6 mol��L��1�����ʱc(OH��)= Kw/ c(H��)= 4��10-14/5��10��6=8��10��9��mol��L��1����

 ͨ��ѧ��Ĭд����ϵ�д�
ͨ��ѧ��Ĭд����ϵ�д� ���ƽ̸�������ѡ����ĩ���100��ϵ�д�
���ƽ̸�������ѡ����ĩ���100��ϵ�д�