题目内容
【题目】A、B、C、D、E、F均为周期表中前四周期元素,其原子序数依次增大,其中A、B、C为短周期非金属元素。A是形成化合物种类最多的元素;B原子基态电子排布中只有一个未成对电子;C是同周期元素中原子半径最小的元素;D的基态原子在前四周期元素的基态原子中单电子数最多;E与D相邻,E的某种氧化物X与C的氢化物的浓溶液加热时反应常用于实验室制取气态单质C;F与D的最外层电子数相等。
回答下列问题(相关回答均用元素符号表示):
(1)D的基态原子的核外电子排布式是______________。
(2)B的氢化物的沸点比C的氢化物的沸点________(填“高”或“低”),原因是______________________。
(3)A的电负性________(填“大于”或“小于”)C的电负性,A形成的氢化物A2H4中A的杂化类型是________。
(4) X在制取C单质中的作用是________,C的某种含氧酸盐常用于实验室中制取氧气,此酸根离子中化学键的键角________(填“>”“=”或“<”)109°28′。

(5)已知F与C的某种化合物的晶胞结构如图所示,则该化合物的化学式是__________________,若F与C原子最近的距离为a cm,则该晶体的密度为________g·cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数的数值为NA)。
【答案】(1)1s22s22p63s23p63d54s1
(2)高 HF分子间能形成氢键
(3)小于 sp2杂化
(4)氧化剂 <
(5)CuCl
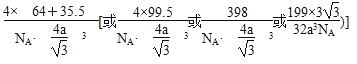
【解析】A是形成化合物种类最多的非金属元素,A为碳元素;B是非金属元素,基态电子排布中只有一个未成对电子,即为氟元素;C是短周期元素,同周期元素中原子半径最小,即氯元素;D的基态原子在前四周期元素的基态原子中单电子数最多,即d轨道5个电子,最外层1个电子,所以为Cr元素;E与D相邻,即E为Mn元素,其氧化物MnO2与浓盐酸反应生成氯气;F的最外层电子数为1,只能是d轨道全充满,即铜元素。(1)D是24号元素,由于未成对电子数最多,所以d轨道5个电子,4s轨道1个电子。(2)氟化氢分子间除范德华力外还存在分子间氢键,氯化氢分子间只存在范德华力,所以氟化氢的沸点高。(3)氯元素非金属性强,电负性大。(4)氯酸钾常用于实验室中制取氧气,ClO3—中存在孤对电子,根据价层电子互斥理论,微粒中键角小于109°28′。(5)用均摊法可求出晶胞中存在4个氯原子、4个铜原子,可得出化学式为CuCl,Cu与Cl原子最近的距离为a cm,通过数学几何知识求出图示中的边长为![]() cm。
cm。
点拨:本题考查元素推断、物质结构与性质相关知识。难度较大。

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
