题目内容
【题目】金属镍硬而有延展性并具有铁磁性,能够高度磨光和抗腐蚀。下图是一种以含镍废料(主要是NiO,含少量FeO、SiO2等杂质)制备Ni的流程:

已知:室温下难溶物的溶度积数据如下表:
化合物 | Ni(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-15 | 10-15 | 10-38 |
(1)滤渣1的主要成分为_____________(填化学式)。
(2)实验中需用0.8mol/L的稀硫酸800mL,若用98%的浓硫酸(ρ=1.84g·mL-l)来配制,量取浓硫酸
时,需使用的量筒的规格为_________(填序号)。
A.10mL B.20mL C.50mL D.l00tnL
(3)用离子方程式解释加入H2O2的作用:_________________。
(4)滴加氨水调节至pH为_________时,铁刚好沉淀完全;若继续滴加氨水至pH为_____________时,镍开始沉淀(假定Ni2+浓度为0.lmol/L)。若上述过程中没有“氧化”步骤,其后果是_______________。
(5)电解制备镍的反应原理如图所示,则A电极的反应式为2H++2e-=H2↑和___________________。

(6)若用a kg含镍废料(含NiO 80%)制备Ni,最终得到产品b kg,则产率为_____________。
【答案】 SiO2 C 2Fe2++H2O2+2H+=2Fe3++2H2O 3 7 Ni2+和Fe2+分离不开 Ni2++2e=Ni ![]()
【解析】本题考查化学工艺流程,(1)NiO和FeO都是碱性氧化物,SiO2属于酸性氧化物,SiO2不与稀硫酸反应,因此滤渣1的成分是SiO2;(2)实验室没有800mL的容量瓶,应用1000mL的容量瓶,根据稀释前后溶质物质的量或质量不变,因此有1000×10-3×0.8=V(H2SO4)×1.84×98%/98,解得V(H2SO4)=43mL,因此选用大而接近的量筒,即选用50mL的量筒,故选项C正确;(3)酸溶后溶液中含有金属阳离子是Ni2+和Fe2+,Fe2+具有还原性,因此加入H2O2的目的是氧化Fe2+,便于除去铁元素,与H2O2发生的离子反应方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;(4)铁元素刚好沉淀完全,此时溶液的c(Fe3+)=10-5mol·L-1,根据Ksp=c(Fe3+)×c3(OH-),代入数值,解得c(OH-)=10-11mol·L-1,则c(H+)=10-3mol·L-1,即pH=3,镍元素开始出现沉淀,依据Ksp=c(Ni2+)×c2(OH-),代入数值,c(OH-)=10-7mol·L-1,则c(H+)=10-7mol·L-1,即pH=7;如果没有氧化步骤,Fe2+开始出现沉淀,Ksp=c(Fe2+)×c2(OH-),代入数值,c(OH-)=10-7mol·L-1,则c(H+)=10-7mol·L-1,即pH=7,其结果是. Ni2+和Fe2+分离不开;(5)根据A电极反应式,推出A电极为阴极,根据电解原理,制备金属镍,因此A电极反应式为2H++2e-=H2↑,Ni2++2e-=Ni;(6)理论上产生Ni的质量为a×103×80%×59/75g,合a×80%×59/75kg,产率为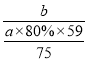 ×100%=
×100%=![]() 。
。





