题目内容
有关能量的判断或表示方法正确的是( )
| A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 |
| B.从C(石墨)═C(金刚石)△H=+1.19kJ?mol-1,可知:金刚石比石墨更稳定 |
| C.由H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1,可知:含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出热量大于57.3kJ |
| D.2gH2完全燃烧生成液态水放出285.8kJ热量,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-285.8kJ?mol-1 |
A、等质量的硫蒸气和硫固体分别完全燃烧,硫固体变化为硫蒸气吸热,所以前者放出热量更多,故A错误;
B、从C(石墨)═C(金刚石)△H=+1.19kJ?mol-1,可知金刚石能量高于石墨,物质能量越高越活泼,越不稳定,石墨比金刚石更稳定,故B错误;
C、由H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1,可知:含0.5mol H2SO4的浓溶液与含1molNaOH的溶液混合,浓硫酸溶解放热,所以反应过程中放出热量大于57.3kJ,故C错误;
D、2g H2完全燃烧生成液态水放出285.8kJ热量,则氢气燃烧的热化学方程式为:H2(g)+
O2(g)═H2O(l)△H=-285.8kJ?mol-1,故D错误;
故选C.
B、从C(石墨)═C(金刚石)△H=+1.19kJ?mol-1,可知金刚石能量高于石墨,物质能量越高越活泼,越不稳定,石墨比金刚石更稳定,故B错误;
C、由H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1,可知:含0.5mol H2SO4的浓溶液与含1molNaOH的溶液混合,浓硫酸溶解放热,所以反应过程中放出热量大于57.3kJ,故C错误;
D、2g H2完全燃烧生成液态水放出285.8kJ热量,则氢气燃烧的热化学方程式为:H2(g)+
| 1 |
| 2 |
故选C.

练习册系列答案
相关题目
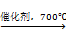 CH2O(g) + H2(g)
CH2O(g) + H2(g) 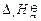 =" 84.2" kJ·mol-1 ⑴
=" 84.2" kJ·mol-1 ⑴