题目内容
已知可逆反应:A(g)+B(g) C(g)+D(g) ΔH<0。请回答下列问题:
C(g)+D(g) ΔH<0。请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(A)="1" mol/L,c(B)="2.4" mol/L,达到平衡时,A的转化率为60%,此时B的转化率为 。
(2)若反应温度降低,则B的转化率将 (填“增大”、“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为c(A)="4" mol·L-1,c(B)=" a" mol·L-1,达到平衡后c(C)="2" mol·L-1,则a= 。
(4)若反应温度不变,反应物的起始浓度分别为c(A)="c(B)=b" mol/L,达到平衡后c(D)= 。(保留两位有效数字)
 C(g)+D(g) ΔH<0。请回答下列问题:
C(g)+D(g) ΔH<0。请回答下列问题:(1)在某温度下,反应物的起始浓度分别为:c(A)="1" mol/L,c(B)="2.4" mol/L,达到平衡时,A的转化率为60%,此时B的转化率为 。
(2)若反应温度降低,则B的转化率将 (填“增大”、“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为c(A)="4" mol·L-1,c(B)=" a" mol·L-1,达到平衡后c(C)="2" mol·L-1,则a= 。
(4)若反应温度不变,反应物的起始浓度分别为c(A)="c(B)=b" mol/L,达到平衡后c(D)= 。(保留两位有效数字)
(1)25% (2)增大 (3)6 (4)0.41b mol/L
(1)根据A的转化率可知,转化A的浓度为0.6 mol·L-1,转化B的浓度也为0.6 mol·L-1,B的转化率为0.6 mol·L-1/2.4 mol·L-1×100%=25%。
(2)因为正反应为放热反应,所以降低温度,平衡向正反应方向移动,B的转化率增大。
(3)根据平衡时C的浓度可知,达到平衡时A、B、C、D的物质的浓度分别为2 mol·L-1、(a-2) mol·L-1、2 mol·L-1、2 mol·L-1,根据(1)可知此温度下的平衡常数为K=(0.6×0.6)/(0.4×1.8)=0.5,所以2×2/[2×(a-2)]=0.5,解得a=6。
(4)设达到平衡后c(D)=x,
则 A(g)+B(g) C(g)+D(g)
C(g)+D(g)
起始mol/L b b 0 0
平衡mol/L b-x b-x x x
则K=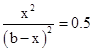
解得x≈0.41b mol/L
(2)因为正反应为放热反应,所以降低温度,平衡向正反应方向移动,B的转化率增大。
(3)根据平衡时C的浓度可知,达到平衡时A、B、C、D的物质的浓度分别为2 mol·L-1、(a-2) mol·L-1、2 mol·L-1、2 mol·L-1,根据(1)可知此温度下的平衡常数为K=(0.6×0.6)/(0.4×1.8)=0.5,所以2×2/[2×(a-2)]=0.5,解得a=6。
(4)设达到平衡后c(D)=x,
则 A(g)+B(g)
 C(g)+D(g)
C(g)+D(g)起始mol/L b b 0 0
平衡mol/L b-x b-x x x
则K=
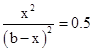
解得x≈0.41b mol/L

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 3X(g)+2Y(g)
3X(g)+2Y(g) 2Z(g) ΔH<0,达到平衡时,下列说法正确的是( )
2Z(g) ΔH<0,达到平衡时,下列说法正确的是( ) Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g) 
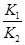
 2SO3(g) ΔH="-196" kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
2SO3(g) ΔH="-196" kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
 FeO(s)+CO(g) ΔH>0。
FeO(s)+CO(g) ΔH>0。 CO(g)+H2(g),试分析和回答下列问题:
CO(g)+H2(g),试分析和回答下列问题: 2SO3(g),其正反应放热。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是
2SO3(g),其正反应放热。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是
 Ni(CO)4(g)+Q
Ni(CO)4(g)+Q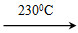 Ni(s)+4CO(g)
Ni(s)+4CO(g) H++Cl-+HClO。下列说法中正确的是( )
H++Cl-+HClO。下列说法中正确的是( )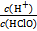 增大
增大