题目内容
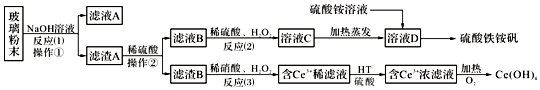
【题目】下图为从海带中提取碘的工业生产过程,有关说法错误的是

A.因海水中蕴藏着极其丰富的碘元素,所以工业上也可以直接用海水来提取碘元素
B.碱化操作时,加入NaOH溶液的原因是在碱性溶液中,可溶性有机质可形成沉淀
C.在实验室进行氧化操作时,加入的氧化剂可以是新制氯水、双氧水等
D.在实验室进行过滤操作时,需要用到玻璃仪器有玻璃棒、烧杯、漏斗
【答案】A
【解析】
试题分析:A. 海水中虽然蕴藏着极其丰富的碘元素,但是浓度很小,不能直接用海水来提取碘元素,A项错误;B.由流程图可知,碱化操作时,加入NaOH溶液的原因是在碱性溶液中,可溶性有机质可形成沉淀,B项正确;C.氧化操作的目的是将I-氧化成I2,所以加入的氧化剂可以是新制氯水、双氧水等,C项正确;D.过滤操作时,需要用到玻璃仪器有玻璃棒、烧杯、漏斗,D项正确;答案选A。

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目