题目内容
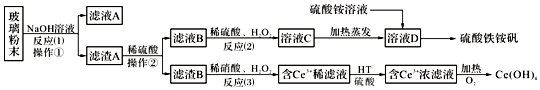
【题目】工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),流程如下:

(1)滤渣I的主要成分是_______________(填化学式)。
(2)还原时,试剂X若选用SO2,则反应后溶液中的阴离子是_________________(填化学式)
(3)检验过滤Ⅰ得到的滤液中存在Fe3+的方法是____________________。
(4)七水合硫酸亚铁(FeSO4·7H2O)在医学上常用作补血剂。某课外小组通过以下实验方法测定某补血剂中亚铁离子的含量。
步骤a:取10片补血剂样品除去糖衣、研磨、溶解、过滤,将滤液配成250mL溶液;
步骤b:取上述溶液25 mL于锥形瓶中,加入少量稀硫酸酸化后,逐渐滴加0.0100 mol/L的KMnO4溶液,至恰好完全反应,记录消耗的KMnO4溶液的体积(假定药品中其他成分不与KmnO4反应),发生的反应为:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O;
步骤c:重复“步骤b”2~3次,平均消耗KMnO4溶液20.00mL。
①步骤a中配制溶液时需要的玻璃仪器除烧杯、胶头滴管外,还需要___________、________。
②该补血剂中亚铁离子的含量为mg/片(请写出计算过程) ___________。
【答案】 SiO2 SO42- 取少量过滤Ⅰ得到的滤液于试管中,向其中加入几滴KSCN溶液,若溶液出现血红色,则说明滤液中含有Fe3+ 玻璃棒 250 mL容量瓶 MnO4-~5Fe2+
25mL溶液中:n(Fe2+) = 5n(MnO4-) = 5×0.0100mol/L×20.00×10-3=10-3mol
250mL溶液中:n(Fe2+)=10-3mol×10 =10-2mol
1片补血剂样品中:n(Fe2+)=10-3mol
m(Fe2+)=10-3mol×56g/mol=56mg
【解析】烧渣中加入稀硫酸,得到硫酸铁、硫酸亚铁和硫酸铝,二氧化硅不反应,过滤,滤渣Ⅰ为二氧化硅,在滤液中加入试剂X,还原硫酸铁得到硫酸铝和硫酸亚铁溶液,调节溶液pH,生成氢氧化铝沉淀,滤渣Ⅱ为氢氧化铝,溶液经蒸发结晶、过滤、洗涤、干燥,可得到FeSO47H2O,则
(1)二氧化硅不与稀硫酸反应,滤渣1为二氧化硅,化学式为SiO2;(2)试剂X若选用SO2,发生反应:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+,则阴离子为SO42-;(3)检验铁离子一般利用KSC溶液,即取少量过滤Ⅰ得到的滤液于试管中,向其中加入几滴KSCN溶液,若溶液出现血红色,则说明滤液中含有Fe3+;(4)①配制250mL溶液需要的玻璃仪器有烧杯、胶头滴管、玻璃棒、250 mL容量瓶;②根据方程式可知MnO4-~5Fe2+,25mL溶液中:n(Fe2+)=5n(MnO4-)=5×0.0100mol/L×0.02L=10-3mol,250mL溶液中:n(Fe2+)=10-3mol×10=10-2mol,因此1片补血剂样品中:n(Fe2+)=10-3mol,所以m(Fe2+)=10-3mol×56g/mol=0.056g=56mg。

 名校课堂系列答案
名校课堂系列答案