题目内容
7.写出下列离子反应的化学方程式:(1)2H++BaCO3═Ba2++CO2↑+H2O2HCl+BaCO3═BaCl2+CO2↑+H2O(一个即可,下同)
(2)Fe3++2OH-═Fe(OH)3↓FeCl3+3NaOH═Fe(OH)3↓+3NaCl.
分析 (1)为酸与碳酸钡的反应,生成可溶性钡盐;
(2)为铁盐与可溶性碱的反应,生成氢氧化铁.
解答 解:(1)为酸与碳酸钡的反应,如盐酸和碳酸钡反应,生成可溶性钡盐,化学方程式为2HCl+BaCO3═BaCl2+CO2↑+H2O,
故答案为:2HCl+BaCO3═BaCl2+CO2↑+H2O;
(2)为铁盐与可溶性碱的反应,生成氢氧化铁,如氯化铁与氢氧化钠,方程式为FeCl3+3NaOH═Fe(OH)3↓+3NaCl,
故答案为:FeCl3+3NaOH═Fe(OH)3↓+3NaCl.
点评 本题考查离子方程式的书写,为高频考点,侧重于基本概念的考查,注意把握离子反应的特点以及离子方程式的书写方法,难度不大.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
17.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 0.5mol O3的质量是16g | B. | 32gO2中含有的氧气分子数为2NA | ||
| C. | 1gH2中含有的电子数为NA | D. | 0.5NA个铜原子的质量为64g |
18.在容量瓶上须要标记的是( )
| A. | 刻度线 | B. | 温度 | C. | 浓度 | D. | 容量 |
15.下列反应的离子方程式正确的是( )
| A. | CuSO4溶液与铁粉反应:2Fe+3Cu2+═2Fe3++3Cu | |
| B. | 实验室制二氧化碳:CaCO3+2H+═CO2↑+H2O+Ca2+ | |
| C. | 二氧化碳与水反应:CO2+H2O═CO32-+2H+ | |
| D. | Na与水反应:Na+2H2O═Na++2OH-+H2↑ |
2.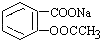 转变为
转变为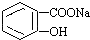 的方法是( )
的方法是( )
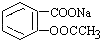 转变为
转变为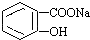 的方法是( )
的方法是( )| A. | 与足量Na0H溶液共热后,再通入CO2 | |
| B. | 溶液加热,通入足量的SO2 | |
| C. | 与稀硫酸共热后,加入足量Na0H溶液 | |
| D. | 足量稀硫酸共热后,加入足量NaHCO3 |
4.氯化铜用途广泛,常用于生产颜料、木材防腐剂等.
(1)实验室用如下装置(部分加热、夹持等装置已略去)制备氯化铜固体.
①仪器z的名称是分液漏斗.
②检验装置A气密性的操作为:关闭活塞,向分液漏斗中加水至其液面高于试管中的液面,(停止加水)一段时间后液面高度差没变化,说明装置不漏气.
③实验过程中按照气流方向仪器接口连接顺序a→hidebc(cb)f,实验中D装置的作用是防止空气中水蒸气进入B,同时吸收多余的Cl2,防止空气污染.
(2)某研究小组模拟工业用粗铜(含杂质Fe)按下述流程制备无水CuCl2.
已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
①溶液A中加入氧化剂X的目的是把Fe2+氧化为Fe3+.
②加试剂Y用于调节pH以除去杂质,则应调节pH范围是3.7≤pH<4.4,试剂Y可选用下列中的cd(填序号).
a.NaOH b.盐酸 c.CuO d.Cu2(OH)2CO3
③由溶液B制备无水CuCl2过程中的操作有:a.冷却结晶;b.过滤洗涤;c.蒸发浓缩;d.在干燥HCl气流中加热.则其操作顺序为cabd(填写序号).
(1)实验室用如下装置(部分加热、夹持等装置已略去)制备氯化铜固体.

①仪器z的名称是分液漏斗.
②检验装置A气密性的操作为:关闭活塞,向分液漏斗中加水至其液面高于试管中的液面,(停止加水)一段时间后液面高度差没变化,说明装置不漏气.
③实验过程中按照气流方向仪器接口连接顺序a→hidebc(cb)f,实验中D装置的作用是防止空气中水蒸气进入B,同时吸收多余的Cl2,防止空气污染.
(2)某研究小组模拟工业用粗铜(含杂质Fe)按下述流程制备无水CuCl2.

已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
| Fe3+ | Cu2+ | Fe2+ | |
| 开始沉淀的pH | 2.7 | 4.4 | 7.0 |
| 沉淀完全的pH | 3.7 | 6.4 | 9.6 |
②加试剂Y用于调节pH以除去杂质,则应调节pH范围是3.7≤pH<4.4,试剂Y可选用下列中的cd(填序号).
a.NaOH b.盐酸 c.CuO d.Cu2(OH)2CO3
③由溶液B制备无水CuCl2过程中的操作有:a.冷却结晶;b.过滤洗涤;c.蒸发浓缩;d.在干燥HCl气流中加热.则其操作顺序为cabd(填写序号).

 CO和NO是汽车尾气的主要污染物.消除汽车尾气的反应式之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).请回答下列问题:
CO和NO是汽车尾气的主要污染物.消除汽车尾气的反应式之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).请回答下列问题: