题目内容
17.NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 0.5mol O3的质量是16g | B. | 32gO2中含有的氧气分子数为2NA | ||
| C. | 1gH2中含有的电子数为NA | D. | 0.5NA个铜原子的质量为64g |
分析 A、臭氧的摩尔质量为48g/mol;
B、根据分子数N=$\frac{m}{M}{N}_{A}$来分析;
C、求出氢气的物质的量,然后根据1mol氢气中含2mol电子来分析;
D、根据质量m=nM来计算.
解答 解:A、臭氧的摩尔质量为48g/mol,故臭氧的质量m=nM=0.5mol×48g/mol=24g,故A错误;
B、32g氧气中含有的分子数N=$\frac{m}{M}{N}_{A}$=$\frac{32g}{32g/mol}{N}_{A}$=NA个,故B错误;
C、1g氢气的物质的量为0.5mol,而1mol氢气中含2mol电子,故0.5mol氢气中含1mol电子即NA个,故C正确;
D、0.5NA个铜原子即0.5mol铜,其质量m=nM=0.5mol×64g/mol=32g,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
7.下列各组物质不能按“→”所示关系实现转化的是(“→”表示反应一步完成)( )
| A. | Fe→FeCl3→FeCl2 | B. | Na2O2→NaOH→Na2CO3 | ||
| C. | H2→NH3→H2O | D. | S→SO3→H2SO4 |
8.配制250mL 0.1mol•L-1的盐酸时,下列实验操作使所配溶液浓度偏大的是( )
| A. | 用量筒量取所需的浓盐酸时俯视刻度线 | |
| B. | 定容时仰视刻度线 | |
| C. | 用量筒量取所需浓盐酸倒入烧杯后,用水洗涤量筒2~3次,洗涤液倒入烧杯中 | |
| D. | 定容后倒转容量瓶几次,发现凹液面最低点低于刻度线,再补几滴蒸馏水 |
5.下列关于84消毒剂(主要成分是NaClO)的使用和保存不正确的是( )
| A. | 将消毒液放在阴凉、避光的地方 | |
| B. | 84消毒剂也可用于漂白 | |
| C. | 在使用时,要适当稀释,消毒液不是越浓越好 | |
| D. | 可与洁厕剂(含有盐酸)混合使用 |
2.胶体与其他分散系的本质区别是( )
| A. | 是否具有丁达尔现象 | B. | 是否均一 | ||
| C. | 是否透明 | D. | 分散质粒子直径大小 |
9.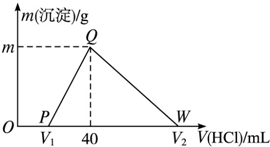 常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol•L-1的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol•L-1的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )
 常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol•L-1的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol•L-1的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )| A. | 原合金质量为0.92g | B. | 图中V2为60 | ||
| C. | 沉淀的质量m为1.56g | D. | OP段发生的反应为:OH-+H+═H2O |