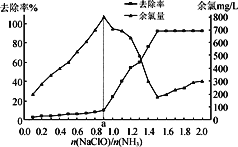
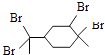
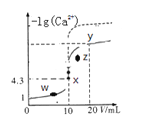
题目内容
【题目】铁粉和氧化亚铁粉末的混合物共9.2克,加入到150毫升的稀硫酸中,恰好完全反应,得到氢气2.24升(标准状况).求:
(1)混合物中铁和氧化亚铁的质量?
(2)原稀硫酸的物质的量浓度?
【答案】
(1)解:n(H2)= ![]() =
= ![]() =0.1mol,
=0.1mol,
Fe+H2SO4=FeSO4+H2↑
1 1
n(Fe) 0.1mol
所以n(Fe)=0.1mol,m(Fe)=5.6g
答:混合物中铁和氧化亚铁的质量分别为Fe 5.6g、FeO 3.6g
(2)解:m(FeO)=9.2g﹣5.6g=3.6g,n(FeO)=0.05mol,
溶质为硫酸亚铁,根据铁元素守恒n(FeSO4)=0.1mol+0.05mol=0.15mol,
所以n(H2SO4)=n(FeSO4)=0.15mol,
C(H2SO4)= ![]() =1mol/L
=1mol/L
答:原稀硫酸的物质的量浓度为1mol/L
【解析】n(H2)= ![]() =
= ![]() =0.1mol,反应的方程式为Fe+H2SO4=FeSO4+H2↑,根据生成氢气的物质的量可计算Fe的质量,进而计算FeO的质量,反应后溶液的成分为FeSO4 , 根据质量守恒可计算硫酸的物质的量,进而计算浓度.
=0.1mol,反应的方程式为Fe+H2SO4=FeSO4+H2↑,根据生成氢气的物质的量可计算Fe的质量,进而计算FeO的质量,反应后溶液的成分为FeSO4 , 根据质量守恒可计算硫酸的物质的量,进而计算浓度.

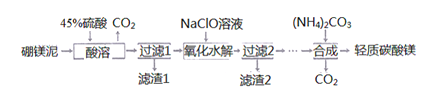
【题目】从废电池外壳中回收锌(锌皮中常有少量铁、外表沾有NH4Cl、ZnCl2、MnO2等杂 质),制取ZnSO4·7H2O可以采取如下工艺流程:
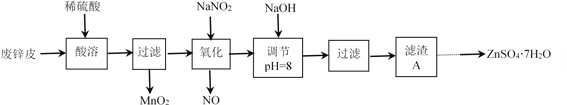
已知:①Zn(OH)2和Al(OH)3化学性质相似;②金属氢氧化物沉淀的pH:
氢氧化物 | 开始沉淀的pH | 完全沉淀的pH |
Zn(OH)2 | 5.7 | 8.0 |
Fe(OH)3 | 2.7 | 3.7 |
请回答下列问题:
(1) “酸溶”时,为了提高酸溶速率,可采取的的措施有:______________(任答一点)。
(2)“氧化”时,酸性滤液中加入NaNO2反应的离子方程式为______________。
(3) “氧化”时,为了减少污染,工业上常用H2O2替代NaNO2。
①若参加反应的NaNO2为0.2 mol,对应则至少需要加入10%H2O2溶液_______________mL(密度近似为1g·cm-3)。
②该过程中加入的H2O2需多于理论值,原因除了提高另外反应物的转化率外,还可能是_____________。
(4) “调节pH”时,若pH>8则造成锌元素沉淀率降低,其原因可能是________________。
(5)将滤渣A溶于适量稀硫酸,调节溶液pH,过滤,将滤液蒸发浓缩,冷却结晶析出ZnSO4·7H2O晶体。则该过程中需调节溶液pH的范围为_____________。