题目内容
20.氮化硅(Si3N4)是高温结构陶瓷,具有优良的性能,人们常常利用它来制造轴承、气轮叶片、永久性模具等机械构件.设计的合成氮化硅工艺流程如下:
(1)①电弧炉中发生的主要化学反应方程式是SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si(粗硅)+2CO↑.
②用石英砂和焦炭在电弧炉中高温加热也可以生产碳化硅,该反应的化学方程式为:SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑,碳化硅俗称金刚砂,具有金刚石结构.
(2)在流化床反应的产物中,SiCl4大约占85%,还有Cl2等,有关物质沸点数据如下表:
| 物质 | Si | SiCl4 | Cl2 |
| 沸点/℃ | 2355 | 57.6 | -34.1 |
A.略小于-34.1℃B.大于57.6℃C.略小于57.6℃D.-34.1℃
(3)①粉末状Si3N4遇水能生成刺激性气味,常用于做制冷剂的气体和一种难溶性的酸,该反应的化学方程式是Si3N4+9H2O=4NH3↑+3H2SiO3↓.
②该合成氨化硅工艺流程中涉及的主要反应属于氧化还原反应的有2个.
分析 (1)①石英砂主要成分为二氧化硅,二氧化硅和碳在高温的条件下反应生成粗硅和一氧化碳;
②用石英砂和焦炭在电弧炉中高温加热生成碳化硅和一氧化碳,具有金刚石结构的碳化硅俗称金刚砂;
(2)分析数据,结合蒸馏原理分析控制沸点分离物质;
(3)①Si3N4遇水水解,生成常用于做制冷剂的气体为氨气,一种难溶性的酸为硅酸,据此书写;
②有元素的化合价变化的反应一定为氧化还原反应结合该合成氨化硅工艺流程中涉及的主要反应分析.
解答 解:(1)①二氧化硅与碳在高温条件下反应生成硅和一氧化碳,化学方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si(粗硅)+2CO↑;
故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si(粗硅)+2CO↑;
②石英砂的主要成分是二氧化硅,在反应中生成碳化硅,反应为:SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑,碳化硅俗称金刚砂,
故答案为:SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑;金刚砂;
(2)在流化床反应的产物中,SiCl4大约占85%,Si+3HCl═SiHCl3+H2,还有Cl2等,利用沸点的不同提纯SiCl4属于蒸馏,SiCl4(沸点57.6℃)中含有少量SiHCl3(沸点33.0℃)和HCl(沸点-84.7℃)和Cl2(沸点-34.1℃),由于沸点差别较大,可以通过精馏(或蒸馏)除去杂质,依据图表数据分析可知,温度应控制在略小于57.6℃,
故答案为:C;
(3)①Si3N4遇水水解,生成常用于做制冷剂的气体为氨气,一种难溶性的酸为硅酸,反应为:Si3N4+9H2O=4NH3↑+3H2SiO3↓,
故答案为:Si3N4+9H2O=4NH3↑+3H2SiO3↓;
②该合成氨化硅工艺流程中发生的主要反应是:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si(粗硅)+2CO↑(氧化还原反应),Si+2Cl2$\frac{\underline{\;△\;}}{\;}$SiCl4(氧化还原反应),3SiCl4+4NH3$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl(非氧化还原反应),
故答案为:2.
点评 本题考查了实验方案设计的有关知识,侧重考查了硅及其化合物的有关知识,注意粗硅的提纯反应原理,题目难度中等.

| A. | 水泥 | B. | 铝合金 | C. | 天然橡胶 | D. | 玻璃钢 |
| A. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42-恰好沉淀完全:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O | |
| B. | 将标准状况下1.12L氯气通入10mL 1mol•L-1的溴化亚铁溶液中:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 | |
| C. | 氢氧化铁溶于氢碘酸溶液:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O | |
| D. | 4mol•L-1的NaAlO2溶液和7mol•L-1的盐酸等体积混合:AlO2-+4H+=Al3++2H2O |
| A. | 硅是构成一些岩石和矿物的基本元素,单质硅是良好的半导体材料 | |
| B. | 水泥、玻璃、水晶饰物都硅酸盐制品 | |
| C. | 玻璃是氧化物,成分可表示为Na2O•CaO•6SiO2 | |
| D. | 硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂等的原料 |
| A. | 常温下,CH3COONa和CH3COOH混合溶液中[pH=7,c(Na+)=0.1mol•L-1]:c(Na+)=c(CH3COO-)>c(H+)=c(OH-) | |
| B. | 在O.1mol•L-1Na2C03溶液中:cc(Na+)=2c(CO32-) | |
| C. | 在O.1mol•L-1NaHC03溶液中:c(HCO3-)>c(CO32-)>c(H2C03) | |
| D. | 向0.2mol•L-1NaHC03溶液中加入等体积O.1mol•L-1NaOH溶液:c(CO32-)+c(HCO3-)+c(OH-)=c(H+)+c(Na+) |
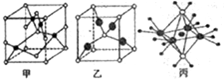
| A. | 单质 | B. | 元素 | C. | 原子 | D. | 分子 |
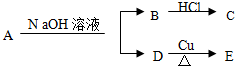 ,又已知D不与Na2CO3溶液反应,C和E都不能发生银镜反应.A的结构可能有( )
,又已知D不与Na2CO3溶液反应,C和E都不能发生银镜反应.A的结构可能有( )