题目内容
10.下列说法正确的是( )| A. | NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构 | |
| B. | 单质的晶体中一定不存在的微粒是阴离子 | |
| C. | P4和CH4都是正四面体分子且键角都为109°28ˊ | |
| D. | NaCl晶体中与每个Na+距离相等且最近的Cl-共有12个 |
分析 A.在ABn型化合物中,中心元素A的族序数+成键数=8时,满足分子中所有原子都满足最外层8电子结构;
B.单质的晶体中一定不存在的微粒是阴离子,可能含有阳离子;
C.白磷的键角是60°;
D.根据NaCl晶体的晶胞示意图可以看出,与每个Na+距离最近且相等的Cl-共有6个.
解答 解:A.NCl3中所有原子都达到8电子结构,故A错误;
B.单质的晶体中一定不存在的微粒是阴离子,可能含有阳离子,如金属晶体,故B正确;
C.白磷是正四面体结构,但键角是60°,CH4正四面体分子且键角为109°28ˊ,故C错误;
D.根据NaCl晶体的晶胞示意图可以看出,与每个Na+距离最近且相等的Cl-共有6个,故D错误;
故选:B.
点评 本题考查较综合,涉及8电子稳定结构的判断、键角的判断、晶体的结构等知识点,注意白磷分子中4个磷原子位于四面体4个顶点上,与甲烷的键角不同,题目难度不大.

练习册系列答案
相关题目
20.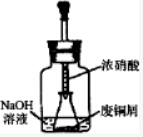 某化学探究小组拟用废铜屑制取Cu(NO3)2并探究其化学性质.
某化学探究小组拟用废铜屑制取Cu(NO3)2并探究其化学性质.
I、如图所示,用浓HNO3和过量的废铜屑充分反应制硝酸铜溶液.
(1)写出铜与浓硝酸反应的离子方程式Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.
(2)①装置中NaOH溶液的作用是吸收氮氧化物,防止污染空气.
②欲从反应后的溶液中得到硝酸铜晶体,实验操作步骤依次是:蒸发浓缩、冷却结晶、过滤、洗涤、烘干.
③你认为此装置是否合理,并说明原因不合理,密闭体系中立即产生大量气体,会有安全隐患;或者合理,慢慢挤压,胶头滴管控制反应速率,使NaOH溶液及时吸收NO2.
Ⅱ、为了探究Cu(NO3)2热稳定性,探究小组按下图装置进行实验.(图中铁架台、铁夹和加热仪器均略去)
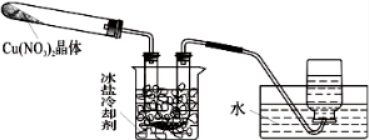
(3)往试管中放入研细的无水Cu(NO3)2晶体并加热,观察到试管中有红棕色气体生成,最终残留黑色粉末;在集气瓶中收集到无色气体.由此判断Cu(NO3)2受热分解的化学方程式为2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑.
Ⅲ、利用Cu(NO3)2制备浅绿色的碱式碳酸铜[CuCO3•Cu(OH)2].
向大试管中加入一定量的碳酸钠溶液和硝酸铜溶液,水浴加热,用0.4mol/L的NaOH溶液调节pH至8.5,振荡、静置、过滤、洗涤、干燥,得到样品.下表是化学探究小组的实验记录,据此回答相关问题:
(4)95℃时,制得的样品颜色发暗的可能原因是:含有黑色的氧化铜.
(5)70℃时,实验得到3.82g样品,取此样品加热至分解完全(杂质不反应),得到3.20g固体,此样品中碱式碳酸铜的质量分数是58.1%.
 某化学探究小组拟用废铜屑制取Cu(NO3)2并探究其化学性质.
某化学探究小组拟用废铜屑制取Cu(NO3)2并探究其化学性质.I、如图所示,用浓HNO3和过量的废铜屑充分反应制硝酸铜溶液.
(1)写出铜与浓硝酸反应的离子方程式Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.
(2)①装置中NaOH溶液的作用是吸收氮氧化物,防止污染空气.
②欲从反应后的溶液中得到硝酸铜晶体,实验操作步骤依次是:蒸发浓缩、冷却结晶、过滤、洗涤、烘干.
③你认为此装置是否合理,并说明原因不合理,密闭体系中立即产生大量气体,会有安全隐患;或者合理,慢慢挤压,胶头滴管控制反应速率,使NaOH溶液及时吸收NO2.
Ⅱ、为了探究Cu(NO3)2热稳定性,探究小组按下图装置进行实验.(图中铁架台、铁夹和加热仪器均略去)

(3)往试管中放入研细的无水Cu(NO3)2晶体并加热,观察到试管中有红棕色气体生成,最终残留黑色粉末;在集气瓶中收集到无色气体.由此判断Cu(NO3)2受热分解的化学方程式为2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑.
Ⅲ、利用Cu(NO3)2制备浅绿色的碱式碳酸铜[CuCO3•Cu(OH)2].
向大试管中加入一定量的碳酸钠溶液和硝酸铜溶液,水浴加热,用0.4mol/L的NaOH溶液调节pH至8.5,振荡、静置、过滤、洗涤、干燥,得到样品.下表是化学探究小组的实验记录,据此回答相关问题:
| 实验序号 | 1 | 2 | 3 | 4 |
| 温度/℃ | 35 | 50 | 70 | 95 |
| 样品颜色 | 深蓝色 | 深蓝色 | 浅绿色 | 暗蓝色 |
(5)70℃时,实验得到3.82g样品,取此样品加热至分解完全(杂质不反应),得到3.20g固体,此样品中碱式碳酸铜的质量分数是58.1%.

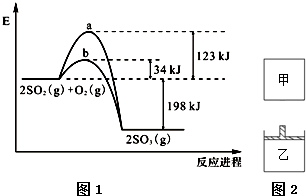
 A的结构式如图,据你所学知识,判断A属于( )
A的结构式如图,据你所学知识,判断A属于( )