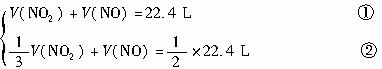题目内容
在80℃、101.3kPa下,用图中装置进行如下实验
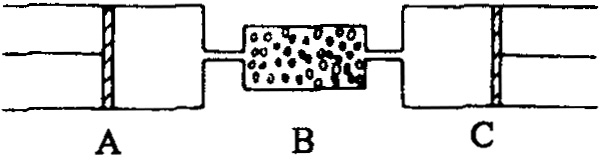
A、C两筒内分别装有无色气体,它们可能含有![]() 等气体.B管内装有固体.推动A的活塞使A筒中的气体缓缓地全部通过B后进入C筒,C中的气体由无色变成红棕色,但其体积换算成同温同压下却未变化.
等气体.B管内装有固体.推动A的活塞使A筒中的气体缓缓地全部通过B后进入C筒,C中的气体由无色变成红棕色,但其体积换算成同温同压下却未变化.
(1)C中发生反应的化学方程式是________,已知原C中气体是单一气体,它是________.将反应后C筒中的气体,用水充分吸收,在同温同压下,气体体积减少一半,则与水反应前C中的气体是________.
(2)若实验开始前A、C中气体的体积分别为1.4DL和2.24L(标准状况),且A中气体经过B管后,B管增重1.40kg,通过计算和推理可判定管中的气体是________,其质量为________g.
解析:
|
本题要从给出的
同时,还可确定B管内的固体物质是
A筒中的气体究竟是 若使C中
当
当 对A、C中气体的定量计算思维过程如下: 设在1.40L
混合气中 A中混合气的质量为 应当注意的是上述计算结果代入试题进行检验: 从B管内出来的
0.84L
反应后C筒中是1.68L
剩余气体1.12L恰为原气体2.24L体积的一半,说明计算结果完全符合题意. |

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案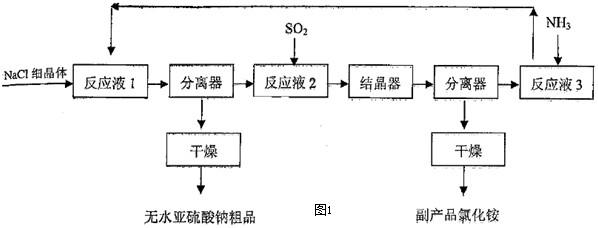
(1)中学化学实验室实现上述流程中“分离器”作用的操作名称是:
(2)“反应液1”是由SO2通入14.8%氨水形成的亚硫酸铵溶液,在60℃~80℃时,不断搅拌,加入NaCl细晶体,就有无水亚硫酸钠析出,析出无水亚硫酸钠的离子反应方程式为
(3)在“反应液2”通入足量SO2后,溶液中的阴离子除OH-外还有
(4)该生产方法的原料利用率(每制100g无水亚硫酸钠,各物质的消耗量及副产品物量)如表格:
| 原料 | 理论值 | 实际值 | 利用率 |
| SO2 | 50.79 | 54.4 | 93.36% |
| NaCl | 92.86 | 101.0 | 91.94% |
| NH3 | 26.98 | 30.5 | 88.46% |
| 副产品NH4Cl | a | 87.1 | -------- |
(5)无水亚硫酸钠粗品常用重结晶的方法进行精制,请完善能实现物料循环的精制亚硫酸钠操作的流程图(如图2所示).