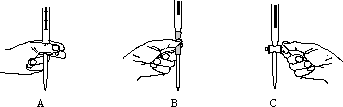题目内容
在化学分析中,一般采用在酸性条件下用高锰酸钾标准溶液滴定的方法测定试样中FeSO4?7H2O的质量分数,反应原理为:5Fe2++8H++MnO4-=5Fe3++Mn2++4H2O.高锰酸钾标准溶液可用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]进行标定,反应原理为:5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O.
实验步骤如下:
步骤一:先粗配浓度约为1.5×10-2mol?L-1的高锰酸钾溶液500mL.
步骤二:称取Na2C2O4固体m g放入锥形瓶中,用蒸馏水溶解并加稀硫酸酸化,加热至70~80℃,用步骤一所配高锰酸钾溶液进行滴定,从而可标定高锰酸钾溶液的浓度.经测定,c(KMnO4)=0.0160mol?L-1
步骤三:称取FeSO4?7H2O试样1.071g,放入锥形瓶中,加入适量的水溶解,
步骤四:用标准高锰酸钾溶液滴定步骤三所配样品溶液,达到终点时消耗标准溶液48.00mL.
试回答下列问题:
(1)步骤一中要用到的玻璃仪器是烧杯、 、 .
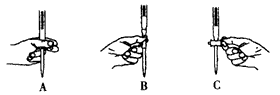
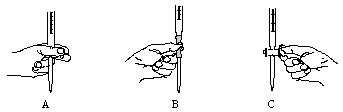
(2)本实验中操作滴定管的如图所示,正确的是 (填编号).
(3)步骤二的滴定是在一定温度下进行的,操作过程中发现前一阶段溶液褪色较慢,中间阶段褪色明显变快,最后阶段褪色又变慢.试根据影响化学反应速率的条件分析,溶液褪色明显变快的原因可能是 .
(4)请设计步骤四中的数据记录和数据处理表格(不必填数据).
(5)国家标准规定FeSO4?7H2O的含量(w):一级品100.5%≥w≥99.50%;二级品100.5%≥w≥99.00%;三级品101.0%≥w≥98.00%.试判断该试样符合国家 级品标准.
(6)测定试样中FeSO4?7H2O的含量时,有时测定值会超过100%,其原因可能是 .
实验步骤如下:
步骤一:先粗配浓度约为1.5×10-2mol?L-1的高锰酸钾溶液500mL.
步骤二:称取Na2C2O4固体m g放入锥形瓶中,用蒸馏水溶解并加稀硫酸酸化,加热至70~80℃,用步骤一所配高锰酸钾溶液进行滴定,从而可标定高锰酸钾溶液的浓度.经测定,c(KMnO4)=0.0160mol?L-1
步骤三:称取FeSO4?7H2O试样1.071g,放入锥形瓶中,加入适量的水溶解,
步骤四:用标准高锰酸钾溶液滴定步骤三所配样品溶液,达到终点时消耗标准溶液48.00mL.
试回答下列问题:
(1)步骤一中要用到的玻璃仪器是烧杯、
(2)本实验中操作滴定管的如图所示,正确的是

(3)步骤二的滴定是在一定温度下进行的,操作过程中发现前一阶段溶液褪色较慢,中间阶段褪色明显变快,最后阶段褪色又变慢.试根据影响化学反应速率的条件分析,溶液褪色明显变快的原因可能是
(4)请设计步骤四中的数据记录和数据处理表格(不必填数据).
(5)国家标准规定FeSO4?7H2O的含量(w):一级品100.5%≥w≥99.50%;二级品100.5%≥w≥99.00%;三级品101.0%≥w≥98.00%.试判断该试样符合国家
(6)测定试样中FeSO4?7H2O的含量时,有时测定值会超过100%,其原因可能是
分析:(1)依据配制溶液的步骤和使用仪器分析;
(2)依据酸式滴定管的使用方法分析判断;
(3)草酸钠标定高锰酸钾溶液的浓度,反应过程中生成的锰离子可能是起到了催化剂作用,反应速率增大;
(4)依据滴定实验步骤中,标准液滴定待测液的操作过程设计数据记录表,标准液需要记录滴定管中开始和滴定终点时溶液的体积,得到消耗标准溶液的体积,进行计算;
(5)依据滴定实验中消耗高锰酸钾溶液的体积和浓度计算物质的量,结合也还原反应离子方程式计算得到亚铁离子物质的量,依据铁元素守恒计算得到FeSO4?7H2O的含量;
(6)此测定方法只是测定铁元素的量,样品质量因为结晶水合物的风化失去结晶水减小,但计算时仍按照结晶水合物减小计算,所以结果会大于100%.
(2)依据酸式滴定管的使用方法分析判断;
(3)草酸钠标定高锰酸钾溶液的浓度,反应过程中生成的锰离子可能是起到了催化剂作用,反应速率增大;
(4)依据滴定实验步骤中,标准液滴定待测液的操作过程设计数据记录表,标准液需要记录滴定管中开始和滴定终点时溶液的体积,得到消耗标准溶液的体积,进行计算;
(5)依据滴定实验中消耗高锰酸钾溶液的体积和浓度计算物质的量,结合也还原反应离子方程式计算得到亚铁离子物质的量,依据铁元素守恒计算得到FeSO4?7H2O的含量;
(6)此测定方法只是测定铁元素的量,样品质量因为结晶水合物的风化失去结晶水减小,但计算时仍按照结晶水合物减小计算,所以结果会大于100%.
解答:解:(1)粗略配制高锰酸钾溶液,先计算所需高锰酸钾质量,利用量筒量取水500ml,用玻璃棒搅拌溶解得到溶液,所以需要的玻璃仪器为量筒、玻璃棒,
故答案为:量筒;玻璃棒;
(2)使用酸式滴定管时,应将滴定管固定在滴定管夹上,活塞柄向右,左手从中间向右伸出,拇指在管前,食指及中指在管后,三指平行地轻轻拿住活塞柄,无名指及小指向手心弯曲,食指及中指由下向上顶住活塞柄一端,拇指在上面配合动作.在转动时,中指及食指不要伸直,应该微微弯曲,轻轻向左扣住,这样既容易操作,又可防止把活塞顶出,
故答案为:A;
(3)草酸钠标定高锰酸钾溶液的浓度,反应过程中生成的锰离子可能是起到了催化剂作用,反应速率增大,
故答案为:生成的Mn2+为催化剂,使反应速率变大;
(4)用标准高锰酸钾溶液滴定步骤三所配样品溶液,达到终点时消耗标准溶液48.00mL,滴定过程中需要读取滴定管中高锰酸钾溶液的起始体积和滴定终点的体积,计算消耗高锰酸钾溶液的体积,三次取平均值计算得到设计的实验报告数据记录表为
故答案为:
(5)c(KMnO4)=0.0160mol?L-1,称取FeSO4?7H2O试样1.071g,放入锥形瓶中加入适量的水溶解,用标准高锰酸钾溶液滴定步骤三所配样品溶液,达到终点时消耗标准溶液48.00mL,依据氧化还原反应离子方程式计算亚铁离子物质的量,得到FeSO4?7H2O物质的量,
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,
1 5
0.0480L×0.0160mol/L n(Fe2+)
n(Fe2+)=0.00384mol
则FeSO4?7H2O试样1.071g中FeSO4?7H2O的质量分数=
×100%=99.67%,
故答案为:99.67%;
(6)此测定方法只是测定铁元素的量,样品质量因为结晶水合物的风化失去结晶水减小,但计算时仍按照结晶水合物减小计算,所以结果会大于100%,
故答案为:FeSO4?7H2O会风化,失去部分结晶水.
故答案为:量筒;玻璃棒;
(2)使用酸式滴定管时,应将滴定管固定在滴定管夹上,活塞柄向右,左手从中间向右伸出,拇指在管前,食指及中指在管后,三指平行地轻轻拿住活塞柄,无名指及小指向手心弯曲,食指及中指由下向上顶住活塞柄一端,拇指在上面配合动作.在转动时,中指及食指不要伸直,应该微微弯曲,轻轻向左扣住,这样既容易操作,又可防止把活塞顶出,
故答案为:A;
(3)草酸钠标定高锰酸钾溶液的浓度,反应过程中生成的锰离子可能是起到了催化剂作用,反应速率增大,
故答案为:生成的Mn2+为催化剂,使反应速率变大;
(4)用标准高锰酸钾溶液滴定步骤三所配样品溶液,达到终点时消耗标准溶液48.00mL,滴定过程中需要读取滴定管中高锰酸钾溶液的起始体积和滴定终点的体积,计算消耗高锰酸钾溶液的体积,三次取平均值计算得到设计的实验报告数据记录表为
| 平行实验编号 | FeSO4?7H2O质量(m) | 滴定管起始读数(mL) | 滴定管滴定终点读数(mL) | 消耗KMnO4溶液体积(mL) |
| 1 | ||||
| 2 | ||||
| 3 |
| 实验编号 | FeSO4?7H2O质量(m) | 滴定管起始读数(mL) | 滴定管滴定终点读数(mL) | 消耗KMnO4溶液体积(mL) |
| 1 | ||||
| 2 | ||||
| 3 |
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,
1 5
0.0480L×0.0160mol/L n(Fe2+)
n(Fe2+)=0.00384mol
则FeSO4?7H2O试样1.071g中FeSO4?7H2O的质量分数=
| 0.00384mol×278g/mol |
| 1.071g |
故答案为:99.67%;
(6)此测定方法只是测定铁元素的量,样品质量因为结晶水合物的风化失去结晶水减小,但计算时仍按照结晶水合物减小计算,所以结果会大于100%,
故答案为:FeSO4?7H2O会风化,失去部分结晶水.
点评:本题考查了物质性质的实验探究和实验验证方法,溶液配制,溶液浓度的标定,氧化还原反应滴定实验的数据处理,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目