题目内容
80℃,101.3 kPa下,用图86装置进行如下实验。A、C两筒内分别装有无色气体,它们可能是NH3、O2、N2、H2S、NO、CO2等气体,B筒内装有Na2O2固体,推动A的活塞使A筒内气体缓缓地全部通过B后进入C筒,C筒内气体由无色变为红棕色,但其体积换算成同温同压下却并未变化(不考虑2NO2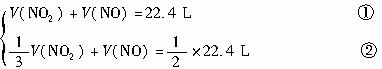
图8-6?
(1)C中发生的反应,其化学方程式是 。已知原C中的气体是单一气体,它是 ,理由是 。?
(2)将反应后C筒内气体用水充分吸收,在同温同压下,气体体积减少一半,则与水反应前 C中的气体是 。?
(3)若实验开始前A、C中气体体积(换算成标准状况)分别为?
(1)2NO+O2![]() 2NO2 NO NO是无色气体,NO转化为NO2时,体积不变,仅是颜色改变 (2)NO和NO2 (3)CO2和O2 2.6?
2NO2 NO NO是无色气体,NO转化为NO2时,体积不变,仅是颜色改变 (2)NO和NO2 (3)CO2和O2 2.6?
解析:没跟水反应前,C筒NO2、NO体积分别为V(NO2)、V(NO),则有?
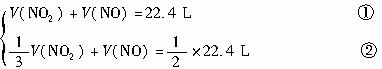
V(NO2)=
由B筒进入C筒中O2体积V(O2)=![]() ×1.68 L=0.84 L。?
×1.68 L=0.84 L。?
设A中CO2、O2的体积分别为V(CO2)和V(O2),由进入C筒中O2计算?
 ?
?
A中气体质量:![]() ×
×![]() ×
×

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
亚硫酸钠用途广泛,可作漂白剂、显影剂、防护剂等.近年来,以SO2、NH3和NaCl为原料生产无水亚硫酸钠的新方法得到发展.生产流程如图1所示:
(1)中学化学实验室实现上述流程中“分离器”作用的操作名称是: ;所需玻璃仪器有 .
(2)“反应液1”是由SO2通入14.8%氨水形成的亚硫酸铵溶液,在60℃~80℃时,不断搅拌,加入NaCl细晶体,就有无水亚硫酸钠析出,析出无水亚硫酸钠的离子反应方程式为 .
(3)在“反应液2”通入足量SO2后,溶液中的阴离子除OH-外还有 ;在“反应液3”中通入足量NH3的目的是: .
(4)该生产方法的原料利用率(每制100g无水亚硫酸钠,各物质的消耗量及副产品物量)如表格:
副产品NH4Cl的理论值a为: ;它与NH4Cl实际值有差别的可能原因是: .
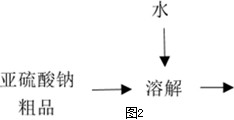
(5)无水亚硫酸钠粗品常用重结晶的方法进行精制,请完善能实现物料循环的精制亚硫酸钠操作的流程图(如图2所示).

(1)中学化学实验室实现上述流程中“分离器”作用的操作名称是:
(2)“反应液1”是由SO2通入14.8%氨水形成的亚硫酸铵溶液,在60℃~80℃时,不断搅拌,加入NaCl细晶体,就有无水亚硫酸钠析出,析出无水亚硫酸钠的离子反应方程式为
(3)在“反应液2”通入足量SO2后,溶液中的阴离子除OH-外还有
(4)该生产方法的原料利用率(每制100g无水亚硫酸钠,各物质的消耗量及副产品物量)如表格:
| 原料 | 理论值 | 实际值 | 利用率 |
| SO2 | 50.79 | 54.4 | 93.36% |
| NaCl | 92.86 | 101.0 | 91.94% |
| NH3 | 26.98 | 30.5 | 88.46% |
| 副产品NH4Cl | a | 87.1 | -------- |
(5)无水亚硫酸钠粗品常用重结晶的方法进行精制,请完善能实现物料循环的精制亚硫酸钠操作的流程图(如图2所示).

 CO(g)+3H2(g)△H=+206.1kJ?mol-1.
CO(g)+3H2(g)△H=+206.1kJ?mol-1.