题目内容
【题目】铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作_____剂。
(2)自然界Cr主要以+3价和+6价(Cr2O72-)存在。+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬。写出离子方程式:_____________________________
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是_________________________________。
(4)由铝土矿生产纯净的氧化铝,流程如下:
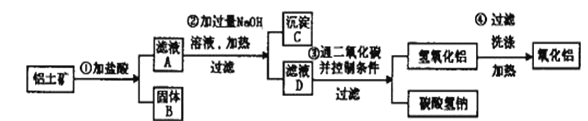
①第一步操作后,若在固体B中加入氢氧化钠溶液_______________(填”会”或”不会”)发生反应。
②验证滤液A中是否含Fe3 +,可取少量滤液A并加入____________(填试剂名称),现象是_________________________________。
③在整个操作过程中______________(填“是”或“否”)有氧化还原反应。
【答案】 氧化 Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O 4Na+TiCl4![]() Ti+4NaCl 会 硫氰酸钾溶液(或KSCN溶液) 溶液显血红色 否
Ti+4NaCl 会 硫氰酸钾溶液(或KSCN溶液) 溶液显血红色 否
【解析】本题考查金属的陌生方程式的书写和工业流程。(1)CeO2在稀硫酸和H2O2的作用下可生成Ce3+,可知CeO2中的Ce由+4价,在H2O2的作用下可生成+3价的Ce3+,因此发生还原反应,CeO2在该反应中作氧化剂;(2)据题意可知用亚硫酸钠将Cr2O72-中的铬还原为+3价,亚硫酸钠自身被氧化为硫酸钠,结合原子守恒和电荷守恒配平书写离子方程式为:Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O;(3)钠与四氯化钛反应制钛的化学反应方程式为:4Na+TiCl4![]() Ti+4NaCl;(4)铝土矿中主要含有氧化铝、氧化铁、二氧化硅等,加酸溶解,得A滤液中主要含有Al3+、Fe3+,固体B中物质为二氧化硅等杂质,滤液A中加入过量的NaOH,则生成沉淀C为氢氧化铁和滤液D为偏铝酸钠。①固体B二氧化硅会与碱反应;②证滤液A中是否含Fe3 +,可取少量滤液A并加入硫氰化钾,溶液呈血红色,即证明滤液A中含有Fe3 + (其他合理答案也可以,如NaOH、红褐色沉淀;苯酚、紫色等),③在整个操作过程中的反应均为涉及到元素化合价的升降,故在整个操作过程中均未涉及到氧化还原反应。
Ti+4NaCl;(4)铝土矿中主要含有氧化铝、氧化铁、二氧化硅等,加酸溶解,得A滤液中主要含有Al3+、Fe3+,固体B中物质为二氧化硅等杂质,滤液A中加入过量的NaOH,则生成沉淀C为氢氧化铁和滤液D为偏铝酸钠。①固体B二氧化硅会与碱反应;②证滤液A中是否含Fe3 +,可取少量滤液A并加入硫氰化钾,溶液呈血红色,即证明滤液A中含有Fe3 + (其他合理答案也可以,如NaOH、红褐色沉淀;苯酚、紫色等),③在整个操作过程中的反应均为涉及到元素化合价的升降,故在整个操作过程中均未涉及到氧化还原反应。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案