题目内容
17.将4体积的H2和1体积的O2混合,4g这种混合气体在标准状况下所占的体积是( )| A. | 5.6 L | B. | 11.2 L | C. | 22.4 L | D. | 33.6 L |
分析 根据M=MA•A%+…+MB•B%计算平均摩尔质量,再根据n=$\frac{m}{M}$计算混合气体总物质的量,根据V=nVm计算气体体积.
解答 解:平均摩尔质量=2 g•mol-1×$\frac{4}{4+1}$+32 g•mol-1×$\frac{1}{4+1}$=1.6 g•mol-1+6.4 g•mol-1=8 g•mol-1
4 g混合气体所占体积:V=$\frac{4g}{8g/mol}$×22.4 L•mol-1=11.2 L,故选B.
点评 本题考查物质的量有关计算,可以向确定氢气、氧气的物质的量之比,再根据总质量计算各自物质的量,注意平均摩尔质量的应用.

练习册系列答案
相关题目
8.如图是一些常见有机物的转化关系,关于反应①~⑦的说法不正确的是( )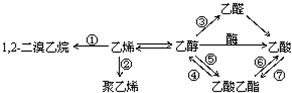

| A. | 反应①是加成反应 | B. | 只有反应②是加聚反应 | ||
| C. | 只有反应⑦是取代反应 | D. | 反应④⑤⑥⑦是取代反应 |
5.已知Ksp(BaSO4 )=1.1×10-10,Ksp(BaCO3)=2.5×10-9.下列说法中不正确的是( )
| A. | BaSO4比BaCO3溶解度小,所以,BaCO3可以转化为BaSO4 | |
| B. | BaCO3、BaSO4均不溶于水,所以都可以做钡餐试剂 | |
| C. | 向Na2CO3溶液中加入BaCl2和Na2SO4,当两种沉淀共存时,$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$=4.4×10-2 | |
| D. | 常温下,BaCO3若要在Na2SO4溶液中开始转化为BaSO4,则Na2SO4的浓度必须不低于 2.2×10-6 mol•L-1 |
12.下列实验中,由于错误操作导致所测出的数据一定偏低的是( )
| A. | 用量筒量取一定体积液体时,俯视读出的读数 | |
| B. | 用标准盐酸滴定未知浓度的NaOH溶液,酸式滴定管未用标准盐酸润洗,所测出的碱液的浓度值 | |
| C. | 同一滴定实验,一般要做三次,取三次实验的平均值进行计算,但某同学只做了一次 | |
| D. | 达到滴定终点时,俯视读数 |
2.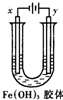 如图装置,U型管中盛有Fe(OH)3胶体,以两个碳棒为电极进行电解,一段时间后,下列叙述正确的是( )
如图装置,U型管中盛有Fe(OH)3胶体,以两个碳棒为电极进行电解,一段时间后,下列叙述正确的是( )
 如图装置,U型管中盛有Fe(OH)3胶体,以两个碳棒为电极进行电解,一段时间后,下列叙述正确的是( )
如图装置,U型管中盛有Fe(OH)3胶体,以两个碳棒为电极进行电解,一段时间后,下列叙述正确的是( )| A. | x是阳极,y是阴极 | B. | x极附近颜色变深,y极近颜色变浅 | ||
| C. | x是阴极,y极附近颜色加深 | D. | y是阴极,x极附近颜色加深 |
9.在BaSO4饱和溶液中加入少量BaCl2溶液,产生BaSO4沉淀,若以Ksp表示BaSO4的溶度积,则平衡后溶液中( )
| A. | C(Ba2+)•C(SO42-)≠Ksp C(Ba2+)<C(SO42-) | |
| B. | C(Ba2+)•C(SO42-)>Ksp C(Ba2+)=C(SO42-) | |
| C. | C(Ba2+)=C(SO42-)=Ksp½ | |
| D. | C(Ba2+)•C(SO42-)=Ksp C(Ba2+)>C(SO42-) |
6.下列说法不正确的是( )
| A. | 法国化学家维勒首次提出有机化学的概念;德国化学家贝采里乌斯由氰酸铵合成了尿素,首次打破了有机物和无机物的界限 | |
| B. | 李比希用燃烧法来测定有机化合物中碳氢元素质量分数 | |
| C. | 用核磁共振氢谱和红外光谱法可以区别乙醇和二甲醚(CH3OCH3) | |
| D. | 用“同位素示踪法”是研究有机化学反应历程的手段之一 |
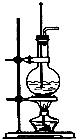 如图为实验室制备乙烯的装置图,请回答:
如图为实验室制备乙烯的装置图,请回答: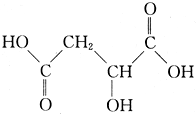 苹果酸是一种常见的有机酸,其结构简式如图所示:
苹果酸是一种常见的有机酸,其结构简式如图所示: