题目内容
【题目】Fe及其化合物在日常生活中有很多应用,请按要求填空:
(1)人体内的铁元素以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。这句话说明维生素C在这一反应中起的作用是_______。(填“还原性”或“氧化性”)
(2)Fe2+是一种非常好的还原剂,能够与很多氧化剂发生反应。在加热条件下,FeSO4可与硫酸酸化的KNO3反应,其中的Fe2+全部转化成Fe3+,KNO3也完全反应并放出NO气体。
①请写出该化学反应方程式,并用单线桥表示出电子转移的方向和数目______。
②上述反应发生还原反应的物质是___。
③若11.4gFeSO4参与反应,则产生NO气体的体积(标况下) ______L。
(3)难溶物FeS能够与硫酸酸化的KMnO4溶液反应,反应方程式如下:10FeS+6KMnO4+24H2SO4=3K2SO4+6MnSO4+5Fe2(SO4)3+l0_____+24H2O
①横线上的物质的化学式是。
②该反应的氧化产物是___。
③若上述反应前后固体的质量减少了2.8g,则硫元素与KMnO4之间发生转移的电子数为___。
【答案】还原性 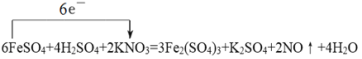 KNO3 0.56L S S、Fe2(SO4)3 0.1NA
KNO3 0.56L S S、Fe2(SO4)3 0.1NA
【解析】
(1)维生素C可使食物中的Fe3+还原成Fe2+,维生素C为还原剂,体现还原性,故答案为:还原性;
(2)①反应中铁元素化合价从+2价升高到+3价,失去1个电子。氮元素化合价从+5价降低到+2价,得到3个电子,根据电子得失守恒可知该反应的化学方程式为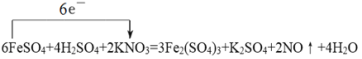 。
。
②根据以上分析可知上述反应发生还原反应的物质是KNO3,故答案为:KNO3;
③11.4gFeSO4的物质的量是11.4g÷152g/mol=0.075mol,所以根据方程式可知产生NO是0.075mol÷3=0.025mol,在标准状况下的体积为0.025mol×22.4L/mol=0.56L。故答案为:0.56L;
(3)①根据原子守恒可知横线上物质的化学式是S;
②反应中Fe和S元素的化合价升高,Mn元素的化合价降低,则该反应的氧化产物是S、Fe2(SO4)3,故答案为:S、Fe2(SO4)3;
③若上述反应前后固体的质量减少了2.8g,根据方程式可知减少的质量是Fe,物质的量是2.8g÷56g/mol=0.05mol,因此参加反应的FeS的物质的量是0.05mol,S元素化合价从-2价升高到0价,所以硫元素与KMnO4之间发生转移的电子的物质的量是0.05mol×2=0.1mol,电子数为0.1NA,故答案为:0.1NA。

【题目】机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知: C(s)+O2(g) =CO2(g) △H1 = 393.5kJ·mol1
2C(s)+O2(g) =2CO(g) △H2 = 221.0 kJ·mol1
N2(g)+O2(g) =2NO(g) △H 3 =+180.5 kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是_________________________。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(104mol·L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(103mol·L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
① 前4 s内的平均反应速率υ(CO) =______mol·L1·s1。
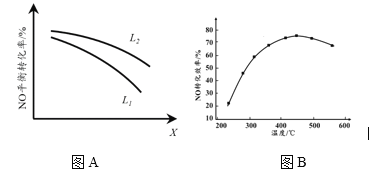
② L、X可分别代表压强或温度。下图A表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是______。判断L1、L2的大小关系______,并简述理由:______________________________。
(3)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数______(填“>”、“<”或“=”)k逆增大的倍数。
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆 =___________。(保留一位小数)
II. 有人利用反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率______(填“是”或者“不是”)对应温度下的平衡转化率,判断理由是________________________;高于450OC时,NO的转化率降低的可能原因是___________(填标号)
N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率______(填“是”或者“不是”)对应温度下的平衡转化率,判断理由是________________________;高于450OC时,NO的转化率降低的可能原因是___________(填标号)
A.催化剂活性降低 B.平衡常数变小 C. 反应活化能增大



