题目内容
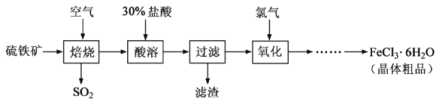
【题目】利用化学原理对工厂排放的废水、废渣等进行有效检测与合理处理。
(一)染料工业排放的废水中含有大量有毒的NO![]() ,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO
,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO![]() 的离子方程式为____________________。
的离子方程式为____________________。
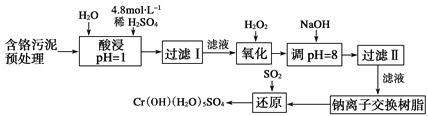
(二)某工厂对制革工业污泥中Cr元素的回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):
常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | - | - | 4.7 | - |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
(1)酸浸时,为了提高浸取率可采取的措施是________(至少写一条)。
(2)H2O2的作用是______________。
(3)调pH=8是为了除去__________(填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(4)钠离子交换树脂的原理为Mn++nNaR―→MRn+nNa+,被交换的杂质离子是____________(填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(5)试配平氧化还原反应方程式:______
![]() Na2Cr2O7+
Na2Cr2O7+![]() SO2+
SO2+![]() H2O===
H2O===![]() Cr(OH)(H2O)5SO4+
Cr(OH)(H2O)5SO4+![]() Na2SO4;
Na2SO4;
每生成1 mol Cr(OH)(H2O)5SO4转移电子的数目为____________。
(三)印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+ 和Fe2+的实验步骤:
①________________________________________________________________________;
②________________________________________________________________________;
③过滤。(提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu)。
【答案】 2Al+OH-+NO2-+2H2O===2AlO2-+NH3H2O 升高温度、搅拌、过滤后再向滤渣中加入硫酸(多次浸取)、适当延长浸取时间(只要答出任意一点即可,其他合理答案也可) 将Fe2+和Cr3+氧化 Fe3+、Al3+ Mg2+、Ca2+ 1 3 11 2 1 3NA 通入足量氯气将Fe2+氧化成Fe3+ 加入CuO调节溶液的pH至3.2~4.7
【解析】(一)由题意,能使湿润的红色石蕊试纸变蓝的气体是氨气,铝与强碱反应生成偏铝酸盐,铝是还原剂,NO2-是氧化剂,所以发生氧化还原反应生成偏铝酸盐和一水合氨,离子方程式为:2Al+OH-+NO2-+2H2O=2AlO2-+NH3H2O。
(二)(1)酸浸时,可从使其充分反应和提高反应速率等方面采取措施来提高浸取率,如:升高温度、搅拌、过滤后再向滤渣中加入硫酸(多次浸取)、适当延长浸取时间等。
(2)由已知pH表结合流程,加双氧水将Fe2+氧化为Fe3+,加NaOH调节pH除去Fe3+和Al3+,同时双氧水也氧化了Cr3+,避免了加NaOH时也被部分除去,故H2O2的作用是将Fe2+和Cr3+氧化。
(3)根据“部分阳离子以氢氧化物形式沉淀时溶液的pH表”,调pH=8时,可除去Fe3+、Al3+。
(4)除去Fe3+、Al3+后溶液中杂质阳离子主要是Ca2+、Mg2+,故被钠离子交换树脂交换的杂质离子是Ca2+、Mg2+。
(5)硫元素的化合价由+4→+6,铬元素化合价由+6→+3,根据得失电子守恒(化合价升降相等),Na2Cr2O7和SO2的系数之比为1:3,再根据原子守恒配平其它部分,结果为:Na2Cr2O7+3SO2+11H2O=2Cr(OH)(H2O)5SO4+Na2SO4;每生成1 mol Cr(OH)(H2O)5SO4转移电子的数目为3NA。
(三)①除去CuCl2溶液中Fe3+和Fe2+,根据“部分阳离子以氢氧化物形式沉淀时溶液的pH表”,若使Fe2+转化为沉淀时,铜离子已经完全沉淀,所以首先把Fe2+氧化为为Fe3+,根据除杂原则,不引入新的杂质,所以可通入足量氯气,故答案为:通入足量氯气将Fe2+氧化成Fe3+;②通入足量氯气后溶液显酸性,所以要加入某种物质调节pH,且不引入新杂质,可加入氧化铜,pH为3.2时,Fe3+沉淀完全,当溶液的pH为4.7时,Cu2+开始沉淀,所以要使Fe3+和Cu2+分离,可加入CuO调节溶液的pH至3.2~4.7。

【题目】某工厂对工业污泥中的Cr元素回收与再利用的工艺如下(己知硫酸浸取液中的金属离子主要是Cr3+,其次是少量的Fe2+、Fe3+、Al3+、Ca2+、Mg2+):

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Fe3* | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时 的pH | 1.9 | 7.0 | — | 一 | — |
沉淀完全时 的pH | 3.2 | 9.0 | 11.1 | 8 | 9 (>9溶解) |
(1)实验室用98% (密度为1.84 g·cm-3)的浓硫酸配制200mL4.8 mol·L-1的硫酸溶液,配制时需要量取98%的浓硫酸的体积为_________mL (保留小数点后一位小数),所用的玻璃仪器除烧杯、玻璃棒、量筒外,还需__________________________________。
(2)在上述配制稀硫酸过程中,会导致所配溶液浓度偏小的操作是____________________(填序号)
a.定容时俯视刻度线 b.量取浓硫酸时,俯视刻度线
c.当容置瓶中液体占容积2/3左右时,未振荡摇匀 d.转移溶液时,没有等溶液冷却至室温
(3)加入H2O2的作用一方面是氧化+3价Cr使之转变成+6价Cr (CrO42-或Cr2O72-),以便于与杂质离子分离;另一方面是_____________________________。(离子方程式表示)
(4)调节溶液的pH=8除去的杂质离子是___________________。
(5)钠离子交换树脂的原理为:Mn++nNaR→MRn +nNa+,被交换的杂质离子是_____________________。
(6)通SO2气体时,还原过程发生以下反应(填写缺项物质并配平)
____________________________________________________________Na2SO4.
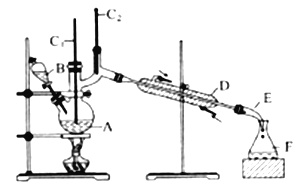
【题目】合成正丁醛的实验装置如图所示。
发生的反应如下:CH3CH2CH2CH2OH![]() CH3CH2CH2CHO
CH3CH2CH2CHO
(正丁醇) (正丁醛)
反应物和产物的相关数据列表如下:
沸点/℃ | 密度(g·cm-3) | 水中溶解性 | |
正丁醇 | 11.72 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中在A中加入4.0g 正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95℃在F中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g。回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,并说明理由________。
(2)加入沸石的作用是________。若加热后发现未加沸石,应采取的正确方法是________。
(3)上述装置图中,E仪器的名称是________,D仪器的名称是________。
(4)分液漏斗使用前必须进行的操作是________(填正确答案标号)。
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在________层(填“上”或“下”)。