题目内容
【题目】(1)工业上常用氨气为原料制备硝酸,其中有一步非常重要的反应为:4NH3+5O2![]() 4NO+6H2O,该反应的氧化剂为______,还原剂为______。用单线桥法表示该氧化还原反应电子转移的方向和数目: _____________。若有标准状况下V L氨气完全反应,并转移n个电子,则阿伏加德罗常数(NA)可表示为______ (写出含字母的表达式)。
4NO+6H2O,该反应的氧化剂为______,还原剂为______。用单线桥法表示该氧化还原反应电子转移的方向和数目: _____________。若有标准状况下V L氨气完全反应,并转移n个电子,则阿伏加德罗常数(NA)可表示为______ (写出含字母的表达式)。
(2)写出下列反应的离子方程式。
①铝片与硝酸汞溶液反应_______________。
②向MgCl2溶液中滴加氨水(NH3·H2O)生成Mg(OH)2沉淀_______________。
(3)向MgCl2溶液中滴加氨水,过滤得到Mg(OH)2沉淀,用蒸馏水对沉淀进行洗涤,洗涤方法是向过滤器中注入蒸馏水,直至没过沉淀,然后等待液体从漏斗底部流出,重复操作2~3次(以除去吸附溶液中的其它离子)。检验该沉淀已经洗净的操作为_______________。
【答案】 O2 NH3 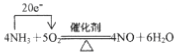 22.4n/5V 3Hg2++2Al=2Al3++3Hg Mg2++2NH3·H2O=Mg(OH)2↓+2NH4+ 取最后一次洗涤液放入试管中,向该溶液中滴加AgNO3溶液,若无沉淀产生则证明沉
22.4n/5V 3Hg2++2Al=2Al3++3Hg Mg2++2NH3·H2O=Mg(OH)2↓+2NH4+ 取最后一次洗涤液放入试管中,向该溶液中滴加AgNO3溶液,若无沉淀产生则证明沉
淀已洗净
【解析】试题分析:本题考查氧化还原反应的分析,离子方程式的书写,基本实验操作。
(1)反应中O元素的化合价由0价降至NO和H2O中的-2价,O2为氧化剂;反应中N元素的化合价由NH3中的-3价升至NO中的+2价,NH3为还原剂;1个NH3分子失去5个电子,则该反应中转移电子20e-,用单线桥分析该反应为: 。每消耗1molNH3转移5mol电子,n(NH3)=
。每消耗1molNH3转移5mol电子,n(NH3)=![]() =
=![]() mol,转移电子物质的量为
mol,转移电子物质的量为![]() mol,阿伏伽德罗常数NA=n
mol,阿伏伽德罗常数NA=n![]() mol=
mol=![]() mol-1。
mol-1。
(2)①铝与硝酸汞溶液发生置换反应,反应的化学方程式为:2Al+3Hg(NO3)2=2Al(NO3)3+3Hg,离子方程式为:2Al+3Hg2+=2Al3++3Hg。
②MgCl2溶液与氨水生成Mg(OH)2沉淀的化学方程式为:MgCl2+2NH3·H2O=Mg(OH)2↓+2NH4Cl,离子方程式为:Mg2++2NH3·H2O=Mg(OH)2↓+2NH4+。
(3)洗涤沉淀的目的是洗涤沉淀上吸附的可溶性杂质,Mg(OH)2沉淀上吸附的可溶性杂质为NH4Cl,检验沉淀是否洗净即检验洗涤液中是否含NH4Cl。检验该沉淀已经洗净的操作为:取最后一次洗涤液放入试管中,向该溶液中滴加AgNO3溶液,若无沉淀产生则证明沉淀已洗净。

【题目】利用化学原理对工厂排放的废水、废渣等进行有效检测与合理处理。
(一)染料工业排放的废水中含有大量有毒的NO![]() ,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO
,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO![]() 的离子方程式为____________________。
的离子方程式为____________________。
(二)某工厂对制革工业污泥中Cr元素的回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):

常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | - | - | 4.7 | - |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
(1)酸浸时,为了提高浸取率可采取的措施是________(至少写一条)。
(2)H2O2的作用是______________。
(3)调pH=8是为了除去__________(填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(4)钠离子交换树脂的原理为Mn++nNaR―→MRn+nNa+,被交换的杂质离子是____________(填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(5)试配平氧化还原反应方程式:______
![]() Na2Cr2O7+
Na2Cr2O7+![]() SO2+
SO2+![]() H2O===
H2O===![]() Cr(OH)(H2O)5SO4+
Cr(OH)(H2O)5SO4+![]() Na2SO4;
Na2SO4;
每生成1 mol Cr(OH)(H2O)5SO4转移电子的数目为____________。
(三)印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+ 和Fe2+的实验步骤:
①________________________________________________________________________;
②________________________________________________________________________;
③过滤。(提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu)。