题目内容
【题目】X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1molL-1 D溶液的pH为13(25℃)。它们满足如图转化关系,则下列说法正确的是

A. 由X、Y、Z、W四种元素组成的盐溶液pH小于7
B. 化合物F中含有共价键和离子键
C. 0.1molB与足量C完全反应共转移电子数为0.2NA
D. Z元素的最高正价为+6
【答案】B
【解析】X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1molL-1D溶液的pH为13(25℃),则D溶液为一元强碱溶液,且其中的金属元素在短周期,则金属元素为Na元素,所以D是NaOH,A和B反应生成强碱,且A和B都是化合物,E是单质,则该反应是过氧化钠和水的反应,所以E是O2,则Z元素是O元素,W的原子序数大于Z,所以W是Na元素;B和C反应生成氧气,两种化合物反应生成氧气的还有过氧化钠和二氧化碳的反应,所以B是Na2O2,则A是H2O,C是CO2,F是Na2CO3,X的原子序数小于Y,则X是H元素,Y是C元素,即X是H、Y是C、Z是O、W是Na元素,A.由X、Y、Z、W四种元素组成的盐是碳酸氢钠,其溶液pH大于7,A错误;B.化合物F是Na2CO3,碳酸钠中钠离子和碳酸根离子之间存在离子键、C原子和O原子之间存在共价键,所以碳酸钠中含有共价键和离子键,B正确;C.B是Na2O2,C是CO2,在B和C的反应中,氧化剂和还原剂都是过氧化钠,0.1molB与足量C完全反应共转移电子数为0.1NA,C错误;D.Z是O元素,其没有正化合价,D错误;答案选B。

【题目】已知在温度低于570 0C 时,还原铁粉与水蒸气反应的产物是FeO,高于570 0C时,生成Fe3O4。老师用上图所示实验装置,完成了还原铁粉与水蒸气反应的演示实验。
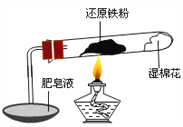
甲同学为探究实验后试管内的固体含有哪些物质,进行了下列实验:
实验编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末放入试管中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
② | 向试管中滴加几滴KSCN溶液,振荡 | 溶液没有出现血红色 |
根据上述实验,下列说法不正确的是( )
A. 试管内的固体一定含有铁粉
B. 试管内的固体一定不含有Fe3O4
C. 不能确定试管内的固体一定含有FeO
D. 可通过将试管内固体彻底还原,分析其质量减小的方法来确定是否含有Fe3O4