题目内容
【题目】纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1价和+2价的化合物。
(1)写出基态Cu+的核外电子排布式___________________________________。
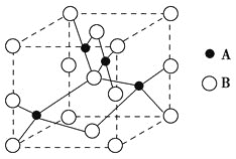
(2)如图是铜的某种氧化物的晶胞示意图,该氧化物的化学式为________。
(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4·H2O沉淀,该物质中的NH3通过________键与中心离子Cu2+结合,NH3分子中N原子的杂化方式是____。与NH3分子互为等电子体的一种微粒是________。
(4)CuO的熔点比CuCl的熔点____(填“高”或“低”)。
【答案】 1s22s22p63s23p63d10或[Ar]3d10 CuO 配位 sp3 H3O+或PH3等 高
【解析】(1)Cu原子核外电子数为29,根据能量最低原理,其核外电子排布式为:1s22s22p63s23p63d104s1,则基态Cu+的核外电子排布式为1s22s22p63s23p63d10或[Ar]3d10;(2)由晶胞示意图可知,1个晶胞中有4个铜,氧为8×![]() +6×
+6×![]() =4个,原子个数之比为1:1,该氧化物的化学式为CuO;(3)NH3中N原子提供孤对电子,Cu2+提供空轨道,形成配位键,NH3分子中N原子的价电子对数 n=
=4个,原子个数之比为1:1,该氧化物的化学式为CuO;(3)NH3中N原子提供孤对电子,Cu2+提供空轨道,形成配位键,NH3分子中N原子的价电子对数 n=![]() ,N原子为 sp3 杂化;与NH3分子互为等电子体的一种微粒具有相同的价电子数和原子数,如PH3或H3O+等;(4)离子化合物中,离子半径越小,离子键越强,熔点越高,离子半径O2-<Cl-,CuO阴阳离子所带电荷大于CuCl阴阳离子所带电荷,CuO中晶格能大,则CuO的熔点比CuCl的熔点高。
,N原子为 sp3 杂化;与NH3分子互为等电子体的一种微粒具有相同的价电子数和原子数,如PH3或H3O+等;(4)离子化合物中,离子半径越小,离子键越强,熔点越高,离子半径O2-<Cl-,CuO阴阳离子所带电荷大于CuCl阴阳离子所带电荷,CuO中晶格能大,则CuO的熔点比CuCl的熔点高。

 名校课堂系列答案
名校课堂系列答案【题目】下列选项中,利用相关实验器材(规格和数量不限)能够完成相应实验的是
选项 | 实验器材 | 相应实验 |
A | 探究化学反应的限度 | 取5mL0.1mol/LKI溶液,滴加0.1mol/L FeCl3溶液5~6滴,可根据溶液中既含I2又含有I-的实验事实判断该反应是可逆反应 |
B | 探究酸性:HCO 3 ->Al(OH) 3 | 向NaHCO3溶液中滴加NaAlO2溶液,观察是否有白色沉淀产生 |
C | 探究浓度对化学反应速率的影响 | 用两只试管各取5mL0.1mol/LKMnO4溶液,分别加入2mL0.1mol/L和1mL0.2mol/LH 2C 2O 4溶液,记录溶液褪色所需要的时间 |
D | 探究氧化性:Cl 2>Br 2>I2 | 向NaBr溶液中滴加氯水,再加入淀粉KI溶液,溶液变蓝 |
A. A B. B C. C D. D
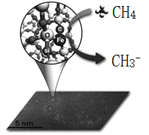
【题目】中科院一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯,如图所示。
物质 | 燃烧热(kJ/mol) |
氢气 | 285.8 |
甲烷 | 890.3 |
乙烯 | 1411.5 |
(1)已知相关物质的燃烧热如上表,写出甲烷制备乙烯的热化学方程式_________。
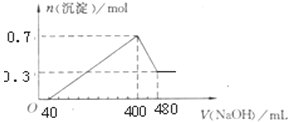
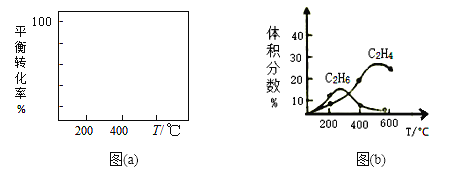
(2)在400℃时,向1L的恒容反应器中充入1molCH4,发生上述反应,测得平衡混合气体中C2H4的体积分数为20.0 %。则在该温度下,其平衡常数K=_______。按化学平衡移动原理,在图(a)中画出该反应的平衡转化率与温度及压强(p1>p2)的关系曲线。_______________________
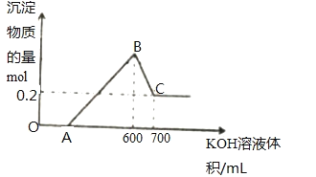
(3)在制备C2H4时,通常存在副反应:2CH4(g)![]() C2H6(g)+H2(g)。在常温下,向体积为1L的恒容反应器中充入1molCH4,然后不断升高温度,得到图(b)。
C2H6(g)+H2(g)。在常温下,向体积为1L的恒容反应器中充入1molCH4,然后不断升高温度,得到图(b)。
①在200℃时,测出乙烷的量比乙烯多的主要原因是_________________________。
②在600℃后,乙烯的体积分数减少的主要原因是__________________________。
(4)工业上常采用除杂效率高的吸收-电解联合法,除去天然气中的杂质气体H2S,并转化为可回收利用的单质硫,其装置如下图所示。
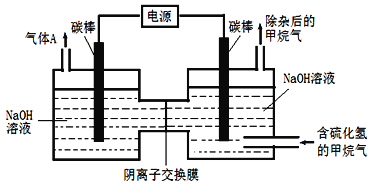
通电前,先通入一段时间含H2S的甲烷气,使部分NaOH吸收H2S转化为Na2S,再接通电源,继续通入含杂质的甲烷气,并控制好通气速率。装置中右端碳棒为_________极,左端碳棒上的电极反应为_________________________,右池中的c(NaOH):c(Na2S)______________(填“增大”、“基本不变”或“减小)。