题目内容
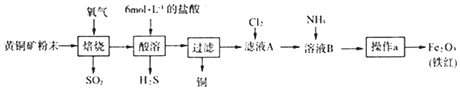
【题目】KClO3是一种常见的氧化剂,常用于医药工业、印染工业和制造烟火.实验室用KClO3和MnO2混合加热制氧气,现取KClO3和MnO2混合物16.60g加热至恒重,将反应后的固体加15g水充分溶解,剩余固体6.55g(25℃),再加5g水充分溶解,仍剩余固体4.80g(25℃).
(1)若剩余的4.80g固体全是MnO2 , 则原混合物中KClO3的质量为g;
(2)若剩余的4.80g固体是MnO2和KCl的混合物
(a)求25℃时KCl的溶解度;
(b)求原混合物中KClO3的质量;
(c)所得KCl溶液的密度为1.72g/cm3 , 则溶液的物质的量浓度为多少?(保留2位小数)
【答案】
(1)11.80
(2)35g,12.25g,5.99mol/L
【解析】解:(1)若剩余的4.80g固体全是MnO2,m(KClO3)=16.60g﹣4.80g=11.80g,
所以答案是:11.80;(2)若剩余的4.80g固体是MnO2和KCl的混合物,则5g水溶解氯化钾得到的溶液是饱和溶液,5g水溶解KCl的质量=6.55g﹣4.80g=1.75g,
(a)则100g水溶解KCl的质量= ![]() ×100g=35g,答:25℃时KCl的溶解度35g;
×100g=35g,答:25℃时KCl的溶解度35g;
(b)20g水溶解氯化钾的质量=1.75g×4=7g,反应前后质量减少的质量为氧气的质量,氧气的质量=16.60g﹣7g﹣4.80g=4.8g,根据氧原子守恒得 ![]() ×122.5g/mol=12.25,答:原混合物中KClO3的质量12.25g;
×122.5g/mol=12.25,答:原混合物中KClO3的质量12.25g;
(c)溶液的质量=20g+7g=27g,溶液的体积= ![]() ,n(KCl)=
,n(KCl)= ![]() ,则溶液的物质的量浓度=
,则溶液的物质的量浓度= ![]() =5.99mol/L,
=5.99mol/L,
答:溶液的物质的量浓度为5.99mol/L.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目