题目内容
5.反应A(g)+3B(g)?2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是( )| A. | υ(D)=0.40 mol•L-1•s-1 | B. | υ(C)=0.50 mol•L-1•s-1 | ||
| C. | υ(A)=0.30 mol•L-1•s-1 | D. | υ(B)=0.60 mol•L-1•s-1 |
分析 不同物质表示的速率之比等于其化学计量数之比,故不同物质的速率之比与其化学计量数的比值越大,表示的反应速率越快,注意单位一致.
解答 解:不同物质表示的速率之比等于其化学计量数之比,故不同物质的速率之比与其化学计量数的比值越大,表示的反应速率越快,
A.$\frac{v(D)}{2}$=0.20 mol•L-1•s-1;
B.$\frac{v(C)}{2}$=0.25 mol•L-1•s-1;
C.$\frac{v(A)}{1}$=0.30 mol•L-1•s-1;
D.$\frac{v(B)}{3}$=0.20 mol•L-1•s-1,
故反应速率C>B>A=D,
故选C.
点评 本题考查化学反应速率快慢比较,难度不大,利用比值法可以迅速判断,也可以转化为同一物质表示的速率进行比较.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.2011年3月日本福岛大地震引起的核泄漏污染物中包含${\;}_{53}^{131}$I等放射性同位素.下列有关${\;}_{53}^{131}$I的说法中,正确的是( )
| A. | 质子数为53 | B. | 中子数为53 | C. | 质子数为131 | D. | 中子数为131 |
16.糖类是人体主要的能量来源.下列物质中,不属于糖类的是( )
| A. | 葡萄糖 | B. | 蔗糖 | C. | 淀粉 | D. | 酶 |
13.下列各组物质中化学键的类型完全相同的是( )
| A. | NaCl MgCl2 Na2O | B. | H2O Na2O ? CO2 | ||
| C. | CaCl2 ? NaOH H2SO4 | D. | NH4Cl H2O CO2 |
20.下列叙述中,不能用平衡移动原理解释的是( )
| A. | 红棕色的NO2,加压后颜色先变深后变浅 | |
| B. | 高压比常压有利于合成SO3的反应 | |
| C. | 由H2(g)、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 | |
| D. | 黄绿色的氯水光照后颜色变浅 |
17.下列有关两种微粒ZAX和ZA+1X+的叙述正确的是( )
| A. | 一定都是由质子、中子、电子组成的 | |
| B. | 化学性质几乎完全相同 | |
| C. | 核电荷数和核外电子数一定相等 | |
| D. | 质子数一定相同,质量数和中子数一定不相同 |
14.雷美替胺是首个没有列为特殊管制的非成瘾失眠症治疗药物,合成该有机物过程中涉及如下转化,下列说法正确的是( )


| A. | 可用溴水区分化合物Ⅱ和化合物Ⅲ | |
| B. | 化合物Ⅰ中所有原子可能在同一平面 | |
| C. | 化合物Ⅰ、Ⅱ、Ⅲ均能与NaHCO3溶液发生反应 | |
| D. | 1 mol化合物Ⅰ最多能与3 mol H2发生加成反应 |
15.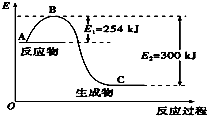 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
(1)如图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,A代表的含义代表反应物的总能量A与C差值代表的含义代表反应热的大小.请写出N2和H2反应的热化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-92KJ/mol.反应过程中加入正向催化剂,E1和E2变化情况变小(变大,变小,不变),△H变化情况不变(变大,变小,不变)假设此反应在密闭容器中反应过程中活化分子百分数变化情况变大(变大,变小,不变).
(2)若已知下列数据
试根据表中及图中数据计算N-H的键能为390kJ•mol-1.
(3)用NH3催化还原NOx还可以消除氮氧化物的污染.
例如:4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H1=-a kJ•mol-1 ①
N2(g)+O2(g)═2NO(g)△H2=-b kJ•mol-1 ②
若1mol NH3还原NO至N2,并生成水蒸气,则该反应过程中的反应热△H3=$\frac{(3b-a)}{4}$kJ•mol-1(用含a、b的式子表示).
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.(1)如图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,A代表的含义代表反应物的总能量A与C差值代表的含义代表反应热的大小.请写出N2和H2反应的热化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-92KJ/mol.反应过程中加入正向催化剂,E1和E2变化情况变小(变大,变小,不变),△H变化情况不变(变大,变小,不变)假设此反应在密闭容器中反应过程中活化分子百分数变化情况变大(变大,变小,不变).
(2)若已知下列数据
| 化学键 | H-H | N≡N |
| 键能/kJ•mol-1 | 435 | 943 |
(3)用NH3催化还原NOx还可以消除氮氧化物的污染.
例如:4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H1=-a kJ•mol-1 ①
N2(g)+O2(g)═2NO(g)△H2=-b kJ•mol-1 ②
若1mol NH3还原NO至N2,并生成水蒸气,则该反应过程中的反应热△H3=$\frac{(3b-a)}{4}$kJ•mol-1(用含a、b的式子表示).
 某学生实验小组,用稀硫酸和稀氢氧化钠溶液在如图所示的装置中,进行中和反应反应热的测定.请回答下列问题:
某学生实验小组,用稀硫酸和稀氢氧化钠溶液在如图所示的装置中,进行中和反应反应热的测定.请回答下列问题: