题目内容
8.2014年10月27日报道:德国、加拿大和我国复旦大学、清华大学的科学家合作成功制得了IrO4+(其结构如图).已知Ir(铱)与Fe同族且基态原子有6个电子层,则下列关于Ir及其化合物的说法错误的是( )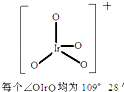
| A. | Ir元素是第六周期第Ⅷ族的金属元素 | |
| B. | IrO4+中Ir的氧化数(即化合价)为+9价 | |
| C. | 在[Ir(CO)3]3-中存在极性键 | |
| D. | IrO4失去1个e-生成IrO4+,发生还原反应 |
分析 A.铁位于第八族,Ir元素有6个电子层位于第六周期;
B.正负化合价的代数和为+1;
C.CO是不同种元素;
D.失电子发生氧化反应.
解答 解:A.铁位于第八族,Ir元素有6个电子层位于第六周期,Ir元素是第六周期第Ⅷ族的金属元素,故A错误;
B.正负化合价的代数和为+1,O为-2价,Ir为+9价,故B错误;
C.CO是不同种元素,是非极性键,故C错误;
D.失电子发生氧化反应,得电子发生还原反应,故D正确.
故选D.
点评 本题考查物质的组成、结构和性质的关系,掌握元素周期表的结构以及元素周期律,题目难度中等.

练习册系列答案
相关题目
18.如图是实验室制备1,2二溴乙烷并进行一系列相关实验的装置(加热及夹持设备已略)反应原理:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,CH2=CH2+Br2CH2BrCH2Br装置A中发生副反应之一是:CH3CH2OH+6H2SO4$\stackrel{△}{→}$2CO2↑+6SO2↑+9H2O.
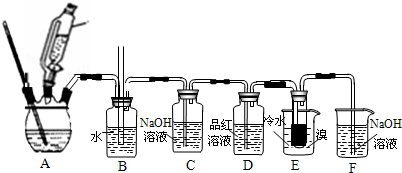
1,2-二溴乙烷主要的物理性质如下:
请回答下列问题:
(1)装置A是由乙醇制备乙烯的反应装置图,其中使用连通滴液漏斗的原因是使连通滴液漏斗里的溶液容易流下.
(2)装置B是安全瓶,用于监测实验进行时E中是否发生堵塞,请写出堵塞时的现象玻璃管中液面上升
装置E中盛放泠水的主要目的是避免溴大量挥发(乙烯与溴反应时放热),但又不能过冷却(如用冰水),其原因是1,2-二溴乙烷的熔点为9.79℃,若温度过低,1,2-二溴乙烷会凝固而堵塞导管.
(3)装置C的作用是吸收乙烯中混有的SO2、CO2,装置F中发生反应的离子方程式为Br2+20H+=Br-+BrO-+H2O
(4)将1,2-二溴乙烷粗产品置于分钟液漏斗中加水,振荡后静置,产物在下层(填“上”或“下”)
(5)有学生提出,装置D中可改用酸性高锰酸钾溶液来验证气体,请判断这种做法是否可行否(填“是”或“否”),其原因是乙烯和SO2均能与酸高锰酸钾溶液反应.

1,2-二溴乙烷主要的物理性质如下:
| 熔点 | 沸点 | 密度 | 溶解性 |
| 9.79℃ | 131.4℃ | 2.18g•cm-3 | 难溶于水,易溶于醇,醚生等有机溶剂 |
(1)装置A是由乙醇制备乙烯的反应装置图,其中使用连通滴液漏斗的原因是使连通滴液漏斗里的溶液容易流下.
(2)装置B是安全瓶,用于监测实验进行时E中是否发生堵塞,请写出堵塞时的现象玻璃管中液面上升
装置E中盛放泠水的主要目的是避免溴大量挥发(乙烯与溴反应时放热),但又不能过冷却(如用冰水),其原因是1,2-二溴乙烷的熔点为9.79℃,若温度过低,1,2-二溴乙烷会凝固而堵塞导管.
(3)装置C的作用是吸收乙烯中混有的SO2、CO2,装置F中发生反应的离子方程式为Br2+20H+=Br-+BrO-+H2O
(4)将1,2-二溴乙烷粗产品置于分钟液漏斗中加水,振荡后静置,产物在下层(填“上”或“下”)
(5)有学生提出,装置D中可改用酸性高锰酸钾溶液来验证气体,请判断这种做法是否可行否(填“是”或“否”),其原因是乙烯和SO2均能与酸高锰酸钾溶液反应.
16.光照下不发生化学变化的一项是( )
| A. | H2和Cl2的混合气体 | B. | Na2O2 | ||
| C. | 新制的氯水 | D. | HNO3 |
17.下列各组变化规律不正确的是( )
| A. | 稳定性:HF>HCl>HBr>HI | B. | 酸性:HClO4>H2SO4>H3PO4 | ||
| C. | 离子半径:N3->O2->F->Na+>Mg2+ | D. | 沸点:F2>Cl2>Br2>I2 |
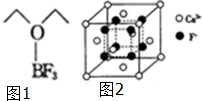 氟及氟产品在工农业生产中应用非常广泛,回答下列问题:
氟及氟产品在工农业生产中应用非常广泛,回答下列问题: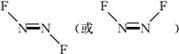 .
.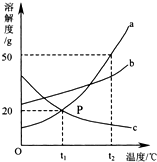 如图是A、B、C三种固体物质的溶解度曲线图,请回答:
如图是A、B、C三种固体物质的溶解度曲线图,请回答: