题目内容
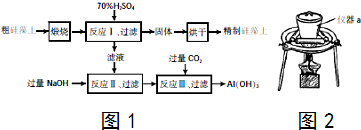
13.亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂.已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.利用图1所示装置制备亚氯酸钠.装置②反应容器为三颈烧瓶.
完成下列填空:
(1)组装好仪器后,检查整套装置气密性的操作是:关闭分液漏斗活塞,打开K1、K2,向①⑤中加水没过干燥管下端,用酒精灯微热三颈烧瓶,若①⑤处有气泡产生,停止加热,一段时间后,①⑤干燥管内形成一段稳定的水柱,说明整套装置气密性良好.
(2)装置②中产生ClO2的化学方程式为2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O.装置④中发生反应的离子方程式为2ClO2+2OH-+H2O2=2ClO2-+2H2O+O2.
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶;②趁热过滤;③用38℃~60℃热水洗涤;④低于60℃干燥,得到成品.
(4)目前已开发出用电解法制取ClO2的新工艺.
①图2是用石墨作电极,一定条件下电解饱和食盐水制取ClO2的示意图.则阳极产生C1O2的电极反应为Cl--5e-+2H2O=ClO2↑+4H+.
②电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解.通过阳离子交换膜的阳离子的物质的量为0.01mol.
(5)准确称取所得亚氯酸钠样品10g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(ClO2-+4I-+4H+═2H2O+2I2+Cl-).将所得混合液配成250mL待测溶液.配制待测液需用到的定量玻璃仪器是250mL容量瓶;取25.00mL待测液,用2.0mol•L-1Na2S2O3标准液滴定(I2+2S2O32-═2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为滴入最后一滴Na2S2O3标准液由蓝色变为无色且半分钟内不变色.重复滴定2次,测得Na2S2O3溶液平均值为20.00mL.该样品中NaClO2的质量分数为90.5%.
分析 (1)利用气体热胀冷缩、容器内外形成压强差检验气密性;
(2)装置②中亚硫酸钠具有还原性,在反应中作还原剂;结合原子守恒可知,还有水生成,配平书写方程式,④中发生反应为二氧化氯在碱性溶液中和过氧化氢发生氧化还原反应生成NaClO2,O2和H2O;
(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,注意温度控制;
(4)①由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,同时生成氢离子;
②在阴极发生2H++2e-=H2↑,通过阳离子交换膜的阳离子为+1价离子,根据n=$\frac{V}{Vm}$计算氢气的物质的量,根据电子转移守恒计算阳离子的物质的量;
(5)①配制溶液的定量仪器是容量瓶,容量瓶要指明规格;
②有碘单质参和生成的反应,一般采用淀粉溶液做指示剂,该反应是Na2S2O3标准液滴定碘,终点溶液由蓝色变为无色且半分钟内不变色;
计算时一般找出关系式,由此进行计算,关系式为ClO2---2I2--4S2O32-,n(ClO2-)=$\frac{1}{4}$n(S2O32-)=$\frac{1}{4}$×20×10-3×2=0.01mol,m(NaClO2)=0.01×90.5=9.05g,计算得到样品中NaClO2的质量分数.
解答 解:(1)组装好仪器后,检查整套装置气密性的操作是关闭分液漏斗活塞,打开K1、K2,向①⑤中加水没过干燥管下端,用酒精灯微热三颈烧瓶,若①⑤处有气泡产生,停止加热,一段时间后,①⑤干燥管内形成一段稳定的水柱,说明整套装置气密性良好,
故答案为:关闭分液漏斗活塞,打开K1、K2,向①⑤中加水没过干燥管下端,用酒精灯微热三颈烧瓶,若①⑤处有气泡产生,停止加热,一段时间后,①⑤干燥管内形成一段稳定的水柱,说明整套装置气密性良好;
(2)亚硫酸钠具有还原性,在反应中作还原剂;装置②中产生ClO2的反应是氯酸钠在酸性溶液中氧化亚硫酸钠为硫酸钠,本身被还原为二氧化氯,反应的化学方程式应为2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O,④中发生反应为二氧化氯在碱性溶液中和过氧化氢发生氧化还原反应生成NaClO2,O2和H2O,反应的离子方程式为2ClO2+2OH-+H2O2=2ClO2-+2H2O+O2,
故答案为:2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;2ClO2+2OH-+H2O2=2ClO2-+2H2O+O2;
(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO2•3H2O,应趁热过滤,由题目信息可知,应控制温度38℃~60℃进行洗涤,低于60℃干燥,
故答案为:趁热过滤;用38℃~60℃热水洗涤;
(4)①由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,同时生成氢离子,电极反应式为:Cl--5e-+2H2O=ClO2↑+4H+,
故答案为:Cl--5e-+2H2O=ClO2↑+4H+;
②在阴极发生2H++2e-=H2↑,氢气的物质的量为$\frac{0.112L}{22.4L/mol}$=0.005mol,通过阳离子交换膜的阳离子为+1价离子,故交换膜的阳离子的物质的量为0.005mol×2=0.01mol,故答案为:0.01;
(5)①将所得混合液配成250mL待测溶液.配制待测液需用到的定量玻璃仪器是250mL容量瓶,容量瓶要指明规格,则选择250mL容量瓶,故答案为:250mL容量瓶;
②有碘单质参和生成的反应,一般采用淀粉溶液做指示剂,该反应是Na2S2O3标准液滴定碘,滴入最后一滴Na2S2O3标准液,终点溶液由蓝色变为无色且半分钟内不变色;
由关系式为ClO2---2I2--4S2O32-,n(ClO2-)=$\frac{1}{4}$n(S2O32-)=$\frac{1}{4}$×20×10-3×2=0.01mol,m(NaClO2)=0.01×90.5=9.05g,
样品中NaClO2的质量分数=$\frac{9.05g}{10g}$×100%=90.5%;
故答案为:滴入最后一滴Na2S2O3标准液由蓝色变为无色且半分钟内不变色;90.5%.
点评 本题考查了物质制备的实验工厂、实验步骤、实验仪器的分析判断,掌握基础是关键,题目难度中等.

| A. | 32g硫 | B. | 64g Cu2+ | ||
| C. | 32g氧气 | D. | 6.02×1024个水分子 |
| A. | $\frac{a}{4b}$mol-1 | B. | $\frac{b}{4a}$mol-1 | C. | $\frac{a}{4b}$ | D. | $\frac{b}{4a}$ |
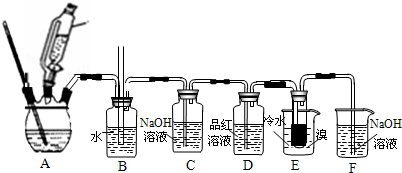
1,2-二溴乙烷主要的物理性质如下:
| 熔点 | 沸点 | 密度 | 溶解性 |
| 9.79℃ | 131.4℃ | 2.18g•cm-3 | 难溶于水,易溶于醇,醚生等有机溶剂 |
(1)装置A是由乙醇制备乙烯的反应装置图,其中使用连通滴液漏斗的原因是使连通滴液漏斗里的溶液容易流下.
(2)装置B是安全瓶,用于监测实验进行时E中是否发生堵塞,请写出堵塞时的现象玻璃管中液面上升
装置E中盛放泠水的主要目的是避免溴大量挥发(乙烯与溴反应时放热),但又不能过冷却(如用冰水),其原因是1,2-二溴乙烷的熔点为9.79℃,若温度过低,1,2-二溴乙烷会凝固而堵塞导管.
(3)装置C的作用是吸收乙烯中混有的SO2、CO2,装置F中发生反应的离子方程式为Br2+20H+=Br-+BrO-+H2O
(4)将1,2-二溴乙烷粗产品置于分钟液漏斗中加水,振荡后静置,产物在下层(填“上”或“下”)
(5)有学生提出,装置D中可改用酸性高锰酸钾溶液来验证气体,请判断这种做法是否可行否(填“是”或“否”),其原因是乙烯和SO2均能与酸高锰酸钾溶液反应.
| A. | NO2 | B. | NO | C. | N2O | D. | NH4NO3 |