题目内容
8.化合物E(含两种元素)与NH3反应,生成化合物G和H2.化合物G的相对分子质量约为81,G分子中硼元素(B相对原子质量为10.8)和氢元素的质量百分含量分别是40%和7.4%.由此推断:(1)化合物G的分子式为B3N3H6;
(2)反应消耗1mol NH3,可生成2mol H2,组成化合物E的元素是氢和硼;
(3)1mol E和2mol NH3恰好完全反应,化合物E的分子式为B2H6.
分析 化合物E(含两种元素)与NH3反应,生成化合物G和H2,则G中应含有氮元素,化合物G的相对分子质量约为81,G分子中硼元素(B相对原子质量为10.8)和氢元素的质量百分含量分别是40%和7.4%,所以分子中B原子数为81×4010.8=3,氢原子数为81×7.41=6,氮原子数为81×(1−4014=3,所以G的分子式为B3N3H6,据此答题;
解答 解:化合物E(含两种元素)与NH3反应,生成化合物G和H2,则G中应含有氮元素,化合物G的相对分子质量约为81,G分子中硼元素(B相对原子质量为10.8)和氢元素的质量百分含量分别是40%和7.4%,所以分子中B原子数为81×4010.8=3,氢原子数为81×7.41=6,氮原子数为81×(1−4014=3,所以G的分子式为B3N3H6,
(1)根据上面的分析可知,化合物G的分子式为B3N3H6,
故答案为:B3N3H6;
(2)化合物E(含两种元素)与NH3反应,生成化合物B3N3H6和H2,反应消耗1mol NH3,可生成2mol H2,根据元素守恒可知组成化合物E的元素是硼元素和氢元素,
故答案为:硼;氢;
(3)1mol E和2mol NH3恰好完全反应,结合反应消耗1mol NH3,可生成2mol H2,根据电子得失守恒可知,反应方程式为3B2H6+6NH3=2B3N3H6+12H2,所以化合物E的分子式为,
故答案为:B2H6;
点评 本题主要考查物质的推断及常见的化学用语,根据元素守恒和元素的质量分数进行物质推断是解题的关键,难度中等.

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目
18.下列化学用语使用正确的是( )
| A. | 6个质子8个中子的碳原子:12C | B. | MgBr2的形成过程用电子式表示为: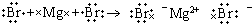 | ||
| C. | HClO的电子式: | D. | H2O的结构式:H-O-H |
19.如图是四种常见有机物的比例模型,下列说法正确的是( )


| A. | 甲中含有少量的乙可以用酸性高锰酸钾溶液除去 | |
| B. | 乙可与溴水发生取代反应使溴水褪色 | |
| C. | 丙中的碳碳键是介于碳碳单键和碳碳双键之间的一种独特的键 | |
| D. | 丁与乙酸能发生中和反应 |
16.下列强碱碱性介于KOH和Mg(OH)2之间的是( )
| A. | NaOH | B. | Al(OH)3 | C. | LiOH | D. | RbOH |
3.元素在元素周期表中的分区说法正确的是( )
| A. | S区的元素一定是主族元素 | B. | d区元素一定是副族元素 | ||
| C. | p区的元素一定是主族元素 | D. | ds区元素一定是副族元素 |
13.38.4mg Cu跟适量的浓硝酸反应,铜全部作用后共收集到气体22.4mL(标准状况),反应消耗的HNO3的物质的量可能是( )
| A. | 1.0×10-3mol | B. | 1.6×10-3mol | C. | 2.2×10-3mol | D. | 2.0×10-3mol |
20.下列说法正确的是( )
| A. | 非金属元素R所形成的含氧酸盐(MaROb)中的R元素必定呈现正价 | |
| B. | 只有非金属能形成含氧酸或含氧酸盐 | |
| C. | 除稀有气体外的非金属元素都能生成不同价态的含氧酸 | |
| D. | 非金属的最高价含氧酸不一定具有强氧化性 |
17.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,测得甲的体积小于乙的体积,则下列说法正确的是( )
| A. | 甲的分子数比乙的分子数多 | |
| B. | 甲的物质的量比乙的物质的量少 | |
| C. | 甲的密度比乙的密度小 | |
| D. | 甲的相对分子质量比乙的相对分子质量大 |
18.反应A(s)=D(g)+E(g),已知△G=△H-T△S=(-4500+11T)J/mol;要防止该反应发生,温度必须( )
| A. | 低于136K | B. | 高于409K | ||
| C. | 高于136K而低于409K | D. | 低于409K |