题目内容
已知:①Na3N+3H2O=3NaOH+NH3↑,②NaH+H2O=NaOH+H2↑。下列叙述正确的是
| A.离子半径:Na+>N3->H+ |
| B.反应①和②都是氧化还原反应 |
| C.反应②每生成1 mol H2,转移的电子数为NA |
| D.Na3N和NaH与盐酸反应都只生成一种盐 |
C
解析试题分析:A、离子的核外电子层数越多离子半径越大。在核外电子排布相同的条件下原子序数越大,离子半径越小,则.离子半径:N3->Na+>H+,A不正确;B、有元素化合价发生变化的反应是氧化还原反应,在反应①中元素的化合价均不变化,不是氧化还原反应。反应②中氢元素的化合价发生变化,属于氧化还原反应,B不正确;C、反应②中氢元素的化合价分别从NaH中-1价和水中+1价变化到0价,注意1个电子,所以反应②每生成1 mol H2,转移的电子数为NA,C正确;D、根据反应①可知Na3N与盐酸反应生成氯化钠和氯化铵两种盐,D不正确,答案选C。
考点:考查离子半径比较、氧化还原反应的有关判断与计算

三氟化氮(NF3)在微电子工业中有重要用途,可由氨气和氟气反应得到,它在潮湿的空气中与水蒸气反应的产物有HF、NO和HNO3。下列说法错误的是
| A.原子半径:N>F |
| B.在与水蒸气反应中,NF3既是氧化剂又是还原剂 |
| C.若NF3泄漏,可用石灰水溶液喷淋的方法减少污染 |
| D.在潮湿空气中反应,被氧化与被还原的元素的物质的量之比为2:1 |
氰氨基化钙是一种重要的化工原料,其制备的化学方程式为:CaCO3+2HCN = CaCN2+CO↑+H2↑+CO2↑,下列说法正确的是
| A.CO为氧化产物,H2为还原产物 | B.CaCN2中含有非极性键 |
| C.HCN既是氧化剂又是还原剂 | D.每消耗10g CaCO3生成2.24L CO2 |
标准状况下,将a L SO2和Cl2组成的混合气体通入100 mL 0.2 mol·L-1Fe2(SO4)3溶液中,充分反应后,溶液的棕黄色变浅。向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为23.3 g。则下列关于该过程的推断不正确的是
| A.混合气体中氯气物质的量为0.04 mol |
| B.混合气体中SO2物质的量为0.04 mol |
| C.所得的沉淀为0.1 mol BaSO4 |
| D.a的取值范围为1.344< a <1.792 |
向100 mL 18 mol/L的硫酸中加入足量铜片,加热并充分反应。下列有关说法正确的是( )
| A.充分反应后转移1.8 mol电子 |
| B.H2SO4只作氧化剂 |
| C.若不加热应生成H2 |
| D.消耗的铜的质量一定少于57.6 g |
在熔融KOH中,大气中的氧可将铬铁矿(FeCr2O4)中Fe和Cr的化合价都转化为+6价,氧化1 mol FeCr2O4在理论上需要氧气( )
| A.2 mol | B.2.5 mol | C.3 mol | D.4 mol |
某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3—、N2、Cl-六种物质。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是( )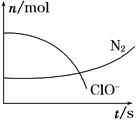
| A.还原剂是含CN-的物质,氧化产物只有N2 |
| B.氧化剂是ClO- , 还原产物是HCO3— |
| C.配平后氧化剂与还原剂的化学计量数之比为5∶2 |
| D.若生成2.24 L N2(标准状况),则转移电子0.5 mol |
工业上可用硫酸铝与硫黄焙烧制备氧化铝:2Al2(SO4)3+3S  2Al2O3+9SO2↑,下列有关说法中正确的是( )
2Al2O3+9SO2↑,下列有关说法中正确的是( )
| A.反应中Al2(SO4)3被氧化 |
| B.Al2(SO4)3、Al2O3均含有离子键和共价键 |
| C.5.1 g Al2O3含有9.03×1022个阴离子 |
| D.该反应中,每转移0.3 mol电子生成5.04 L SO2 |
在下列变化中,需要加入合适的氧化剂才能实现的是( )
| A.HCl→H2 | B.CO2→CO | C.Fe2O3→Fe | D.Br-→Br2 |