题目内容
【题目】I.铝及其化合物用途非常广泛,已知铅(Pb)与硅同主族且Pb比Si多3个电子层。回答下列问题;
(1)硅位于元素周期表的第______周期______族。Pb比Si的原子半径______(填“大”或“小”)
(2)难溶物PbSO4溶于CH3COONH4溶液可制得(CH3COO)2Pb[(CH3COO)2Pb易溶于水],发生的反应为PbSO4+2CH3COONH4=(CH3COO)2Pb+(NH4)2SO4,说明(CH3COO)2Pb是______(填“强”或“弱”)电解质。
(3)铅蓄电池充放电原理为Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,其中工作“B”为______(填“放电”或“充电”)。
2PbSO4+2H2O,其中工作“B”为______(填“放电”或“充电”)。
(4)将PbO2加入硝酸酸化的Mn(NO3)2溶液中搅拌后溶液显紫红色;则每反应1 mol Mn(NO3)2转移____________mol电子。
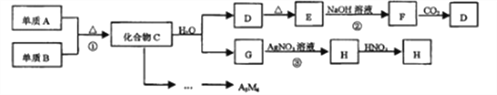
Ⅱ.元素铬(Cr)在自然界主要以+3价和+6价存在。工业上利用铬铁矿(FeO·Cr2O3)冶炼铬的工艺流程如图所示:

(1)水浸I要获得浸出液的操作是______。
(2)常温下Cr(OH)3的溶度积Ksp=1×10-32,若要使Cr3+完全沉淀,则pH为______[c(Cr3+)降至10-5 mol/L可认为完全沉淀]。
(3)以铬酸钠(Na2CrO4)为原料,用电化学法可制备重铬酸钠Na2Cr2O7),实验装置如图所示(已知:2CrO42-+2H+=C2O72-+H2O)。
阳极的电极反应式为______。

【答案】三 ⅣA 大 弱 充电 5 过滤 5(或≥5) 2H2O-4e-=O2↑+4H+(或4OH--4e-=O2↑+2H2O)
【解析】
I.(1)根据硅的原子结构判断其在周期表的位置,根据原子核外电子层数越多,原子半径越大判断;
(2)硫酸铅在水溶液里存在溶解平衡,加入醋酸铵时,醋酸根离子和铅离子生成难电离物质或弱电解质醋酸铅,促进硫酸铅溶解;
(3)铅蓄电池充放电原理为Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,A是原电池,则逆过程是电解池,所以中工作“B”为充电;
2PbSO4+2H2O,A是原电池,则逆过程是电解池,所以中工作“B”为充电;
(4)将PbO2加入硝酸酸化的Mn(NO3)2溶液中,揽拌后溶液显紫红色,说明生成高锰酸根离子,高锰酸根中锰元素为+7价,由此分析解答。
II.(1)由流程可知得到难溶性的固体和液体,该操作为过滤;
(2)根据溶度积常数计算;
(3)阳极发生氧化反应,由水中的氢氧根离子放电,氢离子与CrO42-结合得Cr2O72-;
I.(1)Si是第三周期第IVA的元素,铅与碳是同族元素,且比碳多4个电子层,由于原子核外电子层数越多,原子半径越大,所以原子半径Pb>Si;
(2)硫酸铅在水溶液里存在沉淀溶解平衡,加入醋酸铵时,醋酸根离子和铅离子生成难电离物质即产生弱电解质醋酸铅,促进硫酸铅溶解,说明(CH3COO)2Pb是弱电解质;
(3)铅蓄电池充放电原理为Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,A是原电池,Pb是负极,PbO2是正极,则其逆过程是电解池,所以在工作“B”为充电过程;
2PbSO4+2H2O,A是原电池,Pb是负极,PbO2是正极,则其逆过程是电解池,所以在工作“B”为充电过程;
(4)将PbO2加入硝酸酸化的Mn(NO3)2溶液中,揽拌后溶液显紫红色,说明生成MnO4-离子,在MnO4-中锰元素为+7价,即+2价的锰被氧化成+7价,所以每反应1molMn(NO3)2,转移5mol电子;
II.(1)由流程可知水浸I是分离难溶性的固体与溶液的操作方法,该操作为过滤;
(2)Cr(OH)3的溶度积Ksp=c(Cr3+)c3(OH-)=1×10-32,若c(Cr3+)=10-5mol/L,此时c3(OH-)=![]() =10-27,所以c(OH-)=10-9mol/L,则c(H+)=
=10-27,所以c(OH-)=10-9mol/L,则c(H+)=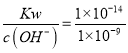 =10-5mol/L,所以溶液的pH=5;
=10-5mol/L,所以溶液的pH=5;
(3)①阳极发生氧化反应,由水中的氢氧根离子放电,电极反应式为:2H2O-4e-=O2↑+4H+(或4OH--4e-=O2↑+2H2O),氢离子与CrO42-结合得Cr2O72-。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案