题目内容
【题目】25℃时,向浓度均为0.1mol·L-1、体积均为100mL的两种一元酸HX、HY溶液中分别加入NaOH固体,溶液中lg![]() 随n(NaOH)的变化如图所示。下列说法正确的是( )
随n(NaOH)的变化如图所示。下列说法正确的是( )
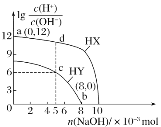
A. HX为弱酸,HY为强酸
B. 水的电离程度:d>c>b
C. c点对应的溶液中:c(Y-)>c(Na+)>c(H+)>c(OH-)
D. 若将c点与d点的溶液全部混合,溶液中离子浓度大小:c(Na+)>c(X-)>c(Y-)>c(H+)>c(OH-)
【答案】C
【解析】
A.lg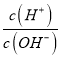 越大,溶液中氢离子浓度越大,未加NaOH时,HX溶液中lg
越大,溶液中氢离子浓度越大,未加NaOH时,HX溶液中lg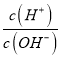 =12,说明c(H+)=0.1mol/L=c(HX),所以HX为强酸,其酸性强于HY,加入氢氧化钠物质的量10×10-3mol,酸HX和氢氧化钠溶液恰好反应,lg
=12,说明c(H+)=0.1mol/L=c(HX),所以HX为强酸,其酸性强于HY,加入氢氧化钠物质的量10×10-3mol,酸HX和氢氧化钠溶液恰好反应,lg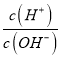 =1,c(H+)=c(OH-),溶液呈中性,故HX为强酸,HY为弱酸,故A错误;B.d点是强酸HX的溶液中滴加NaOH溶液恰好将HX反应一半、剩余一半,故水的电离被强酸抑制;c点加入的氢氧化钠的物质的量为5×10-3mol,所得的溶液为NaY和HY的等浓度的混合溶液,而lg
=1,c(H+)=c(OH-),溶液呈中性,故HX为强酸,HY为弱酸,故A错误;B.d点是强酸HX的溶液中滴加NaOH溶液恰好将HX反应一半、剩余一半,故水的电离被强酸抑制;c点加入的氢氧化钠的物质的量为5×10-3mol,所得的溶液为NaY和HY的等浓度的混合溶液,而lg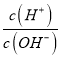 =6,水的离子积Kw=c(H+)c(OH-)=10-14,故可知c(H+)2=10-8,则c(H+)=10-4mol/L,溶液显酸性,即HY的电离大于Y-的水解,水的电离也被抑制;而在b点,加入的氢氧化钠的物质的量为8×10-3mol,所得的溶液为大量的NaY和少量的HY混合溶液,而lg
=6,水的离子积Kw=c(H+)c(OH-)=10-14,故可知c(H+)2=10-8,则c(H+)=10-4mol/L,溶液显酸性,即HY的电离大于Y-的水解,水的电离也被抑制;而在b点,加入的氢氧化钠的物质的量为8×10-3mol,所得的溶液为大量的NaY和少量的HY混合溶液,而lg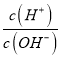 =0,离子积Kw=c(H+)c(OH-)=10-14,故可知c(H+)=10-7,溶液显中性,即HY的电离程度等于Y-的水解程度,水的电离没有被促进也没有被抑制,故水的电离程度d<c<b,故B错误;C.c点加入的氢氧化钠的物质的量为5×10-3mol,所得的溶液为NaY和HY的等浓度的混合溶液,而lg
=0,离子积Kw=c(H+)c(OH-)=10-14,故可知c(H+)=10-7,溶液显中性,即HY的电离程度等于Y-的水解程度,水的电离没有被促进也没有被抑制,故水的电离程度d<c<b,故B错误;C.c点加入的氢氧化钠的物质的量为5×10-3mol,所得的溶液为NaY和HY的等浓度的混合溶液,而lg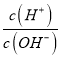 =6,水的离子积Kw=c(H+)c(OH-)=10-14,故可知c(H+)2=10-8,则c(H+)=10-4mol/L,溶液显酸性,即HY的电离大于Y-的水解,故c(Y-)>C(Na+)>c(HY)>c(H+)>c(OH-),故C正确;D.若将c点与d点的溶液全部混合,所得溶液等同NaX、HY等物质的量的混合液,其中X-不水解,HY部分电离,则溶液中离子浓度大小为c(Na+)=c(X-)>c(H+)>c(Y-)>c(OH-),故D错误;答案为C。
=6,水的离子积Kw=c(H+)c(OH-)=10-14,故可知c(H+)2=10-8,则c(H+)=10-4mol/L,溶液显酸性,即HY的电离大于Y-的水解,故c(Y-)>C(Na+)>c(HY)>c(H+)>c(OH-),故C正确;D.若将c点与d点的溶液全部混合,所得溶液等同NaX、HY等物质的量的混合液,其中X-不水解,HY部分电离,则溶液中离子浓度大小为c(Na+)=c(X-)>c(H+)>c(Y-)>c(OH-),故D错误;答案为C。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】(1)钠米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。工业上二氧化钛的制备是:
资料卡片 | ||
物质 | 熔点 | 沸点 |
SiCl4 | -70℃ | 57.6℃ |
TiCl4 | -25℃ | 136.5℃ |
I. 将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应制得混有SiCl4杂质的TiCl4。
II. 将SiCl4分离,得到纯净的TiCl4。
III. 在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O。
IV. TiO2·xH 2O高温分解得到TiO2。
①TiCl4与SiCl4在常温下的状态是________。II中所采取的操作名称是_______。
②III中反应的化学方程式是____________________________________________。
③如IV在实验室完成,应将TiO2·xH2O放在________(填仪器编号)中加热。

(2)根据废水中所含有害物质的不同,工业上有多种废水的处理方法。

①废水I若采用CO2处理,离子方程式是________________。
②废水Ⅱ常用明矾处理。实践中发现废水中的c(HCO![]() )越大,净水效果越好,这是因为______________。
)越大,净水效果越好,这是因为______________。
③废水III中的汞元素存在如下转化(在空格上填相应的化学式):Hg2++______=CH3Hg++H+,我国规定,Hg2+的排放标准不能超过0.05 mg/L。若某工厂排放的废水1 L中含Hg2+ 3×10-7mo1,是否达到了排放标准__(填“是”或“否”)。
④废水Ⅳ常用C12氧化CN—成CO2和N2,若参加反应的C12 与CN-的物质的量之比为5︰2,则该反应的离子方程式为__________。






