题目内容
【题目】近年来由于温室效应和资源短缺等问题,关于CO2和碳酸盐应用的研究受到人们的重视。
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+ CO2(g) = NH2CO2NH4(s) △H = -159.47 kJ·mol-1
②NH2CO2NH4(s) = CO(NH2)2(s)+ H2O(g) △H = +116.49 kJ·mol-1
③H2O(l) = H2O(g) △H = +88.0 kJ·mol-1
试写出NH3和CO2合成尿素和液态水的热化学方程式____________________________。
(2)已知:CO(g) + H2O(g) ![]() H2(g) + CO2(g) △H = -41.2kJ/mol,850℃时在一体积为10 L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图所示:
H2(g) + CO2(g) △H = -41.2kJ/mol,850℃时在一体积为10 L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图所示:
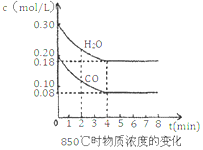
下列说法正确的是______________________(填序号)
A.达到平衡时,氢气的物质的量是0.12mol
B.达到平衡时,反应体系最终会放出49.44kJ热量
C.4min内CO2的反应速率为0.003 mol/(L·min)
D.第8min时,若充入氦气,不会导致v正(CO) < v逆(H2O)
(3)850 ℃时,若在容积为2 L的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,amol CO2和bmol H2。若达平衡时各组分体积分数都与(2)中平衡时相同,则a=____________mol,b=________mol。
(4)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:
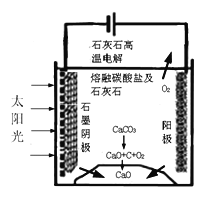
①上述生产过程的能量转化方式是_________________。
②上述电解反应在温度小于900℃时进行碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,阳极的电极反应式为2CO32--4e-=2CO2↑+O2↑,则阴极的电极反应式为__________________________。
【答案】 2NH3(g)+ CO2(g)=CO(NH2)2(s)+H2O(l) △H = -130.98 kJ·mol-1 BD 3.0 3.0 太阳能和电能转化为化学能 3CO2 + 4e-= C + 2CO32-
【解析】(1)已知:①2NH3(g)+ CO2(g) = NH2CO2NH4(s) △H = -159.47 kJ·mol-1
②NH2CO2NH4(s) = CO(NH2)2(s)+ H2O(g) △H = +116.49 kJ·mol-1
③H2O(l) = H2O(g) △H = +88.0 kJ·mol-1
根据盖斯定律可知①+②-③即得到NH3和CO2合成尿素和液态水的热化学方程式为2NH3(g)+ CO2(g)=CO(NH2)2(s)+H2O(l) △H = -130.98 kJ·mol-1。
(2)A.由图可知,平衡时△c(CO)=0.2mol/L-0.08mol/L=0.12mol/L,浓度变化量之比等于化学计量数之比,故△c(H2)=△c(CO)=0.12mol/L,故n(H2)=0.12mol/L×10L=1.2mol,A错误;B.生成1.2mol氢气,放出的热量为41.2kJ×1.2mol/1mol=49.44kJ,B正确;C.4min内CO2的浓度变化量是0.12mol/L,所以反应速率为0.12mol/L÷4min=0.03 mol/(L·min),C错误;D.恒容密闭容器中,若充入氦气,体积不变,各物质的浓度不变,速率不变,D正确,答案选BD;(3)在容积为2L的密闭容器中同时充入1.0mol CO,3.0mol H2O,amol CO2和bmol H2,若要与(2)中平衡是等效平衡,则全部转化为反应物,与(2)中起始的量等比例即可;设实际转化的CO2和 H2为xmol,所以转化为反应物时,c(CO)=(1+x)/2mol/L,c(H2O)=(3+x)/2mol/L,已知(2)中反应物的起始量为c(CO)=0.2mol/L,c(H2O)=0.3mol/L;则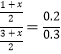 ,解得:x=3;所以初始时CO2和 H2的物质的量均为3mol,即a=b=3;(4)①根据装置图可判断上述生产过程的能量转化方式是太阳能和电能转化为化学能。②阴极发生得到电子的还原反应,反应中有碳生成,则阴极是CO2得到电子,电极反应式为3CO2 +4e-=C+2CO32-。
,解得:x=3;所以初始时CO2和 H2的物质的量均为3mol,即a=b=3;(4)①根据装置图可判断上述生产过程的能量转化方式是太阳能和电能转化为化学能。②阴极发生得到电子的还原反应,反应中有碳生成,则阴极是CO2得到电子,电极反应式为3CO2 +4e-=C+2CO32-。

 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案