题目内容
【题目】Cu的单质和合金在生活、生产中有着广泛的应用。回答下列问题:
(1)Cu的基态原子价电子排布式为___。
(2)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是___,反应的化学方程式为___。
(3)配离子Cu(CN)32-中,中心离子的杂化类型是___,该配离子的空间构型为___;CN-中配位原子是___(填名称)。
(4)CaCux合金可看作由如图所示的(a)、(b)两种原子层交替堆积排列而成。(a)是由Cu和Ca共同组成的层,层中Cu—Cu之间由实线相连;(b)是完全由Cu原子组成的层,Cu—Cu之间也由实线相连。图中虚线构建的六边形,表示由这两种层平行堆积时垂直于层的相对位置;(c)是由(a)和(b)两种原子层交替堆积成CaCux合金的晶体结构图。在这种结构中,同一层的Ca—Cu距离为294pm,相邻两层的Ca—Cu距离为327pm。
①该晶胞中Ca有___个Cu原子配位(不一定要等距最近)。
②同一层中,Ca原子之间的最短距离是___pm,设NA为阿伏加德罗常数的值,CaCu晶体的密度是___g/cm3(用含m、n的式子表示)。

【答案】3d104s1 过氧化氢为氧化剂,氨与Cu2+形成配离子,两者共同作用促使反应进行 Cu+H2O2+4NH3=Cu(NH3)4(OH)2 sp2 平面三角形 碳 18 ![]()
![]()
【解析】
(1)根据构造原理分析;
(2)Cu具有还原性,H2O2具有氧化性,二者反应产生的Cu2+可与氨水结合形成络离子;
(3)根据中心离子Cu+结合的配离子的配位数确定其杂化类型及配离子的空间构型,结合配离子中原子结构确定配位原子;
(4)晶胞由a、b层交替堆积排列而成,根据原子的相对位置分析判断与Ca原子配位的Cu原子个数;结合微粒的相对位置及晶胞密度计算公式计算晶体密度。
(1)Cu是29号元素,核外电子排布式是1s22s22p63s23p63d104s1,基态原子价电子排布式为3d104s1;
(2)H2O2具有强的氧化性,可以将具有还原性的Cu氧化为Cu2+,氨与Cu2+形成配离子,两者共同作用促使反应进行;反应的化学方程式为Cu+H2O2+4NH3=Cu(NH3)4(OH)2;
(3)在Cu(CN)32-中,中心离子Cu+的杂化类型是sp2杂化,微粒的空间构型是平面三角形,其中配位体CN-中的C原子与中心Cu+结合,所以CN-中配位原子是碳原子;
(4)①该Ca-Cu晶胞由a、b层交替堆积排列而成,在a层中Ca原子周围有6个Cu原子,在b层Ca原子周围有12个Cu原子,所以该晶胞中Ca有6+12=18个Cu原子配位;
②晶胞c为平行六面体,a中通过4个相邻的Ca原子的平行四边形为底面,b中平行四边形为晶胞中b层情况:
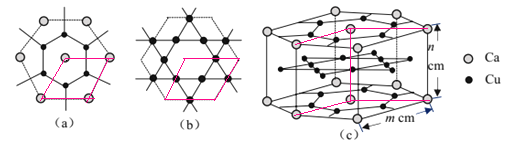
可知晶胞内部1个Cu原子,另外Cu原子位于面上,晶胞中Cu原子数目为1+![]() ×8=5,图a中如图所示等腰三角形
×8=5,图a中如图所示等腰三角形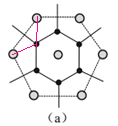 ,锐角为30°,同层相邻Ca-Ca的距离为2×
,锐角为30°,同层相邻Ca-Ca的距离为2×![]() ×294pm=
×294pm=![]() pm;
pm;
在1个晶胞中含有的Ca原子数目为:6×![]() +1=3,含有的Cu原子个数为:6+6+6×
+1=3,含有的Cu原子个数为:6+6+6×![]() =15,晶胞的体积V=6×
=15,晶胞的体积V=6×![]() m2n cm3=
m2n cm3=![]() m2n cm3,则晶胞的密度
m2n cm3,则晶胞的密度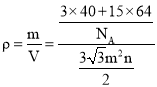 g/cm3=
g/cm3=![]() g/cm3。
g/cm3。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】在一定温度下、1L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示,下列有关说法正确的是
x | y | w | |
n(起始)/mol | 2 | l | 0 |
n(平衡)/mol | l | 0.5 | 1.5 |
A. 该温度下,此反应的平衡常数表达式是![]()
B. 升高温度,若w的体积分数减小,则此反应ΔH>0
C. 增大压强,正、逆反应速率均增大,平衡向正反应方向移动
D. 该温度下,再向容器中通入3molw,达到平衡时,n(x)=2mol