题目内容
1.反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率v(x)(反应物的消耗速率或产物的生成速率)可表示为( )| A. | v(NH3)=0.010mol•L-1•s-1 | B. | v(O2)=0.0010mol•L-1•s-1 | ||
| C. | v(NO)=0.0010mol•L-1•s-1 | D. | v(H2O)=0.045mol•L-1•s-1 |
分析 根据v=$\frac{△c}{△t}$计算v(NO),再利用速率之比等于化学计量数之比计算其它物质表示的速率.
解答 解:在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则v(H2O)=$\frac{\frac{0.45mol}{10L}}{30s}$=0.0015mol•L-1•s-1,速率之比等于化学计量数之比计,则:
v(NH3)=$\frac{2}{3}$v(H2O)=0.001mol•L-1•s-1;
v(O2)=$\frac{5}{6}$v(H2O)=0.00125mol•L-1•s-1;
v(NO)=$\frac{2}{3}$v(H2O)=0.001mol•L-1•s-1,
故选:C.
点评 本题考查化学反应速率有关计算,难度不大,常用定义法与速率规律解答,注意根据速率公式理解速率规律.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11. 甲醇(CH3OH)来源丰富,价格低廉,运输储存方便,是一种重要的化工原料,有着重要的用途和应用前景.
甲醇(CH3OH)来源丰富,价格低廉,运输储存方便,是一种重要的化工原料,有着重要的用途和应用前景.
(1)在25℃、101KPa下,1g甲醇(液态)燃烧生成CO2和液态水放热22.68kJ.则表示甲醇燃烧热的热化学方程式为CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol.(△H的数值保留小数点后1位)
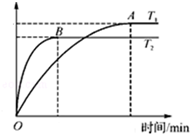
(2)工业上用CO与H2反应生成甲醇(催化剂为Cu2O/ZnO).一定条件下,在体积为3L的密闭容器中进行反应:CO(g)+2H2(g)?CH3OH(g).甲醇的物质的量随温度的变化如图所示,请回答下列问题:
①该反应正向为放热反应(填“放热”或“吸热”),升高温度,平衡常数K<(填“增大”、“减小”或“不变”).
②该反应的△S<0(填“>”或“<”)在较低(填“较高”或“较低”)温度下有利于该反应自发进行.
③温度为T2时,从反应开始到平衡,H2表示的平均反应速率v(H2)=$\frac{2nB}{3tB}$mol/(L.min).
④在其他条件不变的情况下,将处于C点的平衡体系体积压缩到原来的1/2,重新平衡时,下列有关该体系的说法正确的是BC.
A. H2的浓度减小 B.甲醇的百分含量增大 C.$\frac{c(C{H}_{3}OH)}{{c}^{2}({H}_{2})•c(CO)}$减小 D.$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$增大
(3)已知反应2CH3OH(g)═CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:v正> v逆(填“>”、“<”或“=”).
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=0.04mol/L,该时间内反应速率v(CH3OH)=0.16mol/L.
 甲醇(CH3OH)来源丰富,价格低廉,运输储存方便,是一种重要的化工原料,有着重要的用途和应用前景.
甲醇(CH3OH)来源丰富,价格低廉,运输储存方便,是一种重要的化工原料,有着重要的用途和应用前景.(1)在25℃、101KPa下,1g甲醇(液态)燃烧生成CO2和液态水放热22.68kJ.则表示甲醇燃烧热的热化学方程式为CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol.(△H的数值保留小数点后1位)
(2)工业上用CO与H2反应生成甲醇(催化剂为Cu2O/ZnO).一定条件下,在体积为3L的密闭容器中进行反应:CO(g)+2H2(g)?CH3OH(g).甲醇的物质的量随温度的变化如图所示,请回答下列问题:
①该反应正向为放热反应(填“放热”或“吸热”),升高温度,平衡常数K<(填“增大”、“减小”或“不变”).
②该反应的△S<0(填“>”或“<”)在较低(填“较高”或“较低”)温度下有利于该反应自发进行.
③温度为T2时,从反应开始到平衡,H2表示的平均反应速率v(H2)=$\frac{2nB}{3tB}$mol/(L.min).
④在其他条件不变的情况下,将处于C点的平衡体系体积压缩到原来的1/2,重新平衡时,下列有关该体系的说法正确的是BC.
A. H2的浓度减小 B.甲醇的百分含量增大 C.$\frac{c(C{H}_{3}OH)}{{c}^{2}({H}_{2})•c(CO)}$减小 D.$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$增大
(3)已知反应2CH3OH(g)═CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=0.04mol/L,该时间内反应速率v(CH3OH)=0.16mol/L.
12.用Na2CO3粉末配制1mol/L的Na2CO3100mL,配制中需用仪器的先后顺序是( )
①托盘天平 ②量筒 ③50mL烧杯 ④药匙 ⑤100mL容量瓶 ⑥胶头滴管 ⑦玻璃棒.
①托盘天平 ②量筒 ③50mL烧杯 ④药匙 ⑤100mL容量瓶 ⑥胶头滴管 ⑦玻璃棒.
| A. | ①③⑤⑥⑦ | B. | ④①③⑦⑤⑥ | C. | ④①⑤⑦⑥ | D. | ④②③⑦⑤⑥ |
9.下列叙述中正确的是( )
| A. | 离子晶体中肯定不含共价键 | B. | 离子晶体都易溶于水 | ||
| C. | 分子晶体的熔、沸点一般较低 | D. | 原子晶体键长越大,键能越大 |
16.下列说法不正确的是(NA为阿伏加德罗常数)( )
| A. | 124 g P4(正四面体结构)含有P-P键的个数为6NA | |
| B. | 18 g NH4+中含有N-H键键长和键能均相同,且个数为4NA | |
| C. | 12 g金刚石中含有C-C键的个数为2NA | |
| D. | 60gSiO2中含Si-O键的个数为2NA |
6.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 含有 NA个氦原子的氦气在标准状况下的体积约为11.2L | |
| B. | 25℃,1.01×105Pa,64g SO2中含有的原子数为3NA | |
| C. | 标准状况下,22.4L CCl4中含有的C原子数目为NA | |
| D. | 物质的量浓度为0.5 mol•L-1的MgCl2溶液中,所含Cl-个数为NA |
13.下列关于平衡常数的说法中,正确的是( )
| A. | 化学平衡常数用来定量描述化学反应的限度 | |
| B. | 利用化学平衡常数判断化学反应进行的快慢 | |
| C. | 平衡常数的大小与温度、浓度、压强、催化剂有关 | |
| D. | 对于一个化学反应达到平衡之后,若只改变一个因素使得平衡发生移动,则K值一定变化 |
10.下列说法正确的是( )
| A. | 反应能否自发进行与温度无关 | |
| B. | 能自发进行的化学反应,一定是△H>0、△S>0 | |
| C. | 放热反应一定都是自发的 | |
| D. | 电解池的反应不属于自发过程 |
11.下列过程一定有化学变化发生的是( )
| A. | 淀粉水解 | B. | 酒精挥发 | C. | 水结成冰 | D. | 碘的升华 |