题目内容
已知:25℃ H2C2O4K1 = 5.4×10-2,K2 = 5.4×10-5;H2CO3 K1=4.5×10-7,K2= 4.7×10-11;下列离子方程式一定不正确的是
| A.H2C2O4 +CO32-= HCO3-+HC2O4- | B.HC2O4-+CO32-= HCO3-+C2O42- |
| C.H2C2O4 +HCO3-=HC2O4-+H2O+CO2 | D.H2C2O4+CO32-= C2O42-+H2O+CO2 |
A
解析试题分析:根据电离常数知酸性强弱顺序是:H2C2O4>HC2O4->H2CO3>HCO3-,根据强酸制取弱酸知草酸和碳酸根离子反应生成草酸根离子和二氧化碳,草酸氢根离子和碳酸根离子反应生成碳酸氢根离子和草酸根离子。故A选项错误。
考点:弱电解质在水溶液中的电离平衡

练习册系列答案
相关题目
25℃时,下列叙述中,正确的是( )
| A.CH3COONa溶液中:c(Na+) = c(CH3COO-) |
| B.pH=3的醋酸溶液加水稀释过程中:溶液中各离子浓度均变小 |
| C.pH相同的NaOH溶液与NaHCO3溶液中:水的电离程度相同 |
| D.pH=9的NaHX溶液中: c(H2X)>c(X2-) |
常温下,有关①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液,四种溶液的比较中,正确的是
| A.水电离的c(H+):①=②=③=④ |
| B.将②、③溶液混合后pH=7,则消耗溶液的体积:②=③ |
| C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大 |
| D.向溶液中加入100mL水后,溶液的pH:③>④>①>② |
下列液体均处于25℃,有关叙述正确的是
| A.某物质的溶液pH<7,向该溶液中加入氢氧化钠溶液,Kw增大 |
| B.pH=8的NaOH溶液稀释100倍,其pH=6 |
| C.将1L 0.1mol·L-1的Ba(OH)2溶液稀释为2L,pH=12 |
| D.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
在某温度时,测得纯水中的c(H+)=2.4×10-7mol/L,则c(OH-)为
| A.2.4×10-7mol/L | B.0.1×10-7mol/L |
C.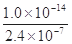 mol/L mol/L | D.无法确定 |
盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是( )
| A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO和OH- |
| B.NaHCO3溶液中:c (H+)+ c (H2CO3)=c(OH-) |
| C.10 mL0.10mol·L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同 |
常温时,用1.0mol/L NaOH溶液中和某浓度硫酸溶液时,其pH 和所加NaOH溶液的体积关系如图所示。原硫酸溶液的物质的量浓度和完全反应后溶液的总体积是
| A.1 mol/L 60mL | B.0.5 mol/L80mL |
| C.0.5 mol/L40mL | D.1 mol/L80mL |
25℃时,将稀氨水逐滴滴加到稀硫酸中,当溶液的pH=7时,下列关系正确的是( )
| A.c(NH4+)=c(SO42-) |
| B.c(NH4+)>c(SO42-) |
| C.c(NH4+)<c(SO42-) |
| D.c(NH4+)+c(SO42-)=c(H+)=c(NH4+) |
酸碱完全中和时
| A.酸和碱的物质的量一定相等 |
| B.酸所提供的H+与碱提供的OH-的物质的量相等 |
| C.酸和碱的物质的量浓度相等 |
| D.溶液一定呈中性 |