题目内容
4.A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D、E、F同周期,A、D同主族,C、F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素.又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体.请回答下列问题:(1)从周期表中每一周期最后一种元素的原子序数(2、10、18、36、54、…..),推测第十周期最后一个元素的原子序数为290,元素D在周期表中的位置第三周期第ⅠA族,元素F的名称硫.
(2)C元素的氢化物与F元素氢化物的沸点高低H2O>H2S.(用化学式表示)
(3)C、D、F三种元素形成的简单离子的半径由小到大的顺序是(用离子符号表示)S2->O2->Na+.
(4)由A、B、C三种元素以原子个数比4:2:3形成化合物X中所含化学键类型有离子键、共价键.
(5)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:SiO2+2OH-═SiO32-+H2O.
(6)FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的离子方程式2SO2+O2+2H2O═4H++2SO42-.
分析 A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,C元素的原子最外层电子数是次外层电子数的三倍,C原子有2个电子层,最外层电子数为6,故C为氧元素;C与F为同一主族,则F为硫元素;D、E、F同周期,即处于第三周期,D是所在周期原子半径最大的元素,故D为Na元素;D、E、F均为固体,六种元素所形成的常见单质在常温压下有三种是气体,三者时固体,则A、B单质为气体,A与D为同一主族,则A为H元素;B的原子序数小于氧元素,则B为氮元素;(5)中若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,则E为Al,若E为非金属元素,其单质在电子工业中有重要应用,则E为Si元素,据此解答.
解答 解:A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,C元素的原子最外层电子数是次外层电子数的三倍,C原子有2个电子层,最外层电子数为6,故C为氧元素;C与F为同一主族,则F为硫元素;D、E、F同周期,即处于第三周期,D是所在周期原子半径最大的元素,故D为Na元素;D、E、F均为固体,六种元素所形成的常见单质在常温压下有三种是气体,三者时固体,则A、B单质为气体,A与D为同一主族,则A为H元素;B的原子序数小于氧元素,则B为氮元素.
(1)同族元素中相邻的两种元素的原子序数之差与下一周期中元素种数相同,第一周期到第十周期中各周期最多容纳元素种类为:2、8、8、18、18、32、32、50、50、72,所以每一周期最后一个元素的原子序数为2、10、18、36、54、…,所以第十周期最后一个元素的原子序数为2+8+8+18+18+32+32+50+50+72=290,元素D为Na,在周期表中的位置:第三周期第ⅠA族,元素F的名称为硫,
故答案为:290;第三周期第ⅠA族;硫;
(2)C元素、F元素的氢化物分别为H2O、H2S,二者均为分子晶体,水分子之间存在氢键,其沸点高于硫化氢的,故答案为:H2O>H2S;
(3)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:S2->O2->Na+,故答案为:S2->O2->Na+;
(4)由H、N、O三种元素以原子个数比4:2:3形成化合物X为NH4NO3,所含化学键类型有:离子键、共价键,故答案为:离子键、共价键;
(5)中若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,则E为Al,反应方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,若E为非金属元素,其单质在电子工业中有重要应用,则E为Si元素,二氧化硅溶于氢氧化钠溶液的离子方程式为:SiO2+2OH-═SiO32-+H2O,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;SiO2+2OH-═SiO32-+H2O;
(6)SO2与氧气和水蒸气反应的离子方程式:2SO2+O2+2H2O═4H++2SO42-,
故答案为:2SO2+O2+2H2O═4H++2SO42-.
点评 本题考查结构性质位置关系,难度中等,旨在考查学生对基础知识的理解掌握,推断元素是解题关键.

| A. | 标准状况下,1.12L氦气所含原子数为0.1NA | |
| B. | 9g D216O所含的中子数为4.5 NA | |
| C. | 22.4 LHCl溶于水,溶液中H+数为NA | |
| D. | 1.6gNH2-离子所含质子数为NA |
| A. | 单质:是否只含一种原子 | |
| B. | 氧化还原反应:元素化合价是否变化 | |
| C. | 共价化合物:是否含有共价键 | |
| D. | 强电解质:熔融状态下是否完全电离 |
| A. | 碘酒 | B. | HCl(气态) | C. | 水煤气 | D. | 豆浆 |
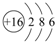 ;
; .
.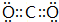 ,②写出B与C形成的化合物C2B的电子式:
,②写出B与C形成的化合物C2B的电子式: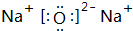 .
.