题目内容
19.实验室用氢氧化钠固体配置1.0mol/L的氢氧化钠溶液500ml,回答下面问题:(1)简要叙述该实验的实验步骤;
①计算; ②称量; ③溶解冷却;
④移液; ⑤洗涤; ⑥定容;
⑦摇匀装瓶;
(2)所需仪器为:容量瓶(规格:500mL)、托盘天平,还需要哪些实验仪器才能完成实验请写出天平、药匙、烧杯、玻璃棒、胶头滴管.
分析 实验室配制一定物质的量浓度溶液的一般步骤为:计算、称量、溶解冷却、移液、洗涤、定容、摇匀装瓶,
依据配制溶液的体积选择合适的容量瓶,依据实验步骤选择需要的仪器.
解答 解:(1)实验室配制一定物质的量浓度溶液的一般步骤为:计算、称量、溶解冷却、移液、洗涤、定容、摇匀装瓶;
故答案为:计算、称量、溶解冷却、移液、洗涤、定容、摇匀装瓶;
(2)配制1.0mol/L的氢氧化钠溶液500ml,应选择500mL容量瓶,依据配制步骤:计算、称量、溶解冷却、移液、洗涤、定容、摇匀装瓶,可知需要的仪器:天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,
所以还需要哪些实验仪器:天平、药匙、烧杯、玻璃棒、胶头滴管;
故答案为:500mL;天平、药匙、烧杯、玻璃棒、胶头滴管;
点评 本题考查了配制一定物质的量浓度溶液,明确配制原理和实验步骤是解题关键,侧重考查学生对基本实验的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.元素周期表是学习和研究化学的重要工具.请根据下表(元素周期表的部分内容)回答有关问题:
(1)请从上表中查出关于硼元素的一条信息:硼元素的相对原子量为10.81.
(2)表中3至10号元素位于第二周期,11至18号元素位于第三周期,分析其规律可知,每一周期元素原子的电子层数 相同.
(3)第11号元素与第17号元素组成的化合物是NaCl,构成该物质的微粒是离子(选填“分子”、“原子”或“离子”).
(4)如图A、B、C是三种粒子的结构示意图.试回答下列问题:
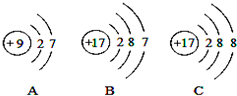
①A、B、C中属于同种元素的粒子是B和C;
②A和B两种粒子的最外层电子数相同,所以它们具有相似的化学性质.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥIA | VIIA | 0 |
| 2 | 3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
| 3 | 11 Na 钠 22.99 | 12Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
(2)表中3至10号元素位于第二周期,11至18号元素位于第三周期,分析其规律可知,每一周期元素原子的电子层数 相同.
(3)第11号元素与第17号元素组成的化合物是NaCl,构成该物质的微粒是离子(选填“分子”、“原子”或“离子”).
(4)如图A、B、C是三种粒子的结构示意图.试回答下列问题:

①A、B、C中属于同种元素的粒子是B和C;
②A和B两种粒子的最外层电子数相同,所以它们具有相似的化学性质.
7.下列各组物质的标准燃烧热相等的是( )
| A. | 碳和一氧化碳 | B. | 1mol碳和2mol碳 | ||
| C. | 1mol乙炔和2mol碳 | D. | 淀粉和纤维素 |
14.a g水中含有b个氢原子,则阿伏伽德罗常数为( )
| A. | 9a/b mol-1 | B. | 9b/a 1mol-1 | C. | b/a mol-1 | D. | a/bmol- |