题目内容
16.想一想:Ba(OH)2(液态)、CuSO4(固态)、纯CH3COOH这些物质为什么归为一类,下列哪些物质还可以和它们归为一类( )| A. | 碘酒 | B. | HCl(气态) | C. | 水煤气 | D. | 豆浆 |
分析 混合物是两种或两种以上的物质组成,纯净物是单一的一种物质,由同种分子构成的物质是纯净物,由不同种分子构成的物质是混合物.
解答 解:混合物是两种或两种以上的物质组成,纯净物是单一的一种物质,由同种分子构成的物质是纯净物,由不同种分子构成的物质是混合物.
Ba(OH)2(固体)、CuSO4(固体)、纯CH3COOH都只含有一种物质,是纯净物.
A.碘酒是乙醇和碘的混合物,故A错误;
B.氯化氢气体是纯净物,故B正确;
C.水煤气是一氧化碳和氢气的混合物,故C错误;
D.豆浆是蛋白质,水等的混合物,故D错误;
故选B.
点评 本题考查纯净物和混合物的区别,题目难度不大,要分析物质是由几种物质组成的,如果只有一种物质组成就属于纯净物,如果有多种物质就属于混合物.

练习册系列答案
相关题目
5.下列有关元素化合物的叙述中正确的是( )
| A. | 碱金属原子的最外层电子数都是1,次外层电子数都是8 | |
| B. | 将SO2通入滴有紫色石蕊试液的水中,溶液变成红色 | |
| C. | 白磷易溶于水,不能保存在水中 | |
| D. | 高性能通信材料光 导纤维的主要原料是单品硅 |
4.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如下:
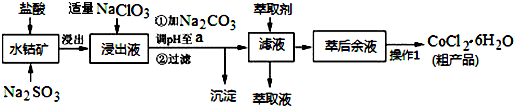
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
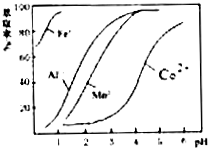
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴.
(1)盐酸浸取水钴矿时为提高浸出率可采取的有效措施有研磨、搅拌、升温、适当增加酸的浓度、增加浸出时间(答一条即可),写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出该反应的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(2)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(3)“操作1”中包含3个基本实验操作,依次是蒸发(浓缩)、冷却(结晶)和过滤.
(4)萃取剂对金属离子的萃取率与pH的关系如图.其使用的最佳pH范围是B.
A.1.0~2.0 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)盐酸浸取水钴矿时为提高浸出率可采取的有效措施有研磨、搅拌、升温、适当增加酸的浓度、增加浸出时间(答一条即可),写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出该反应的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(2)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(3)“操作1”中包含3个基本实验操作,依次是蒸发(浓缩)、冷却(结晶)和过滤.
(4)萃取剂对金属离子的萃取率与pH的关系如图.其使用的最佳pH范围是B.

A.1.0~2.0 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
1.已知Cu+2Fe3+═Cu2++2Fe2+,Zn+2Fe3+═Zn2++2Fe2+,现把等物质的量的CuSO4、FeCl3和Zn置于水中,充分反应后,反应器中所得混合物除了SO42-、Cl-外还有( )
| A. | Zn2+、Cu、Fe2+ | B. | Zn2+、Cu2+、Fe、Fe2+ | ||
| C. | Zn2+、Cu2+、Fe2+ | D. | Zn2+、Cu2+、Cu、Fe2+ |
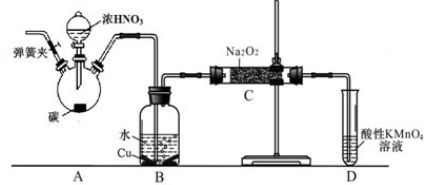
8.根据要求完成下列各小题实验目的.(a、b为弹簧夹,加热及固定装置已略去)
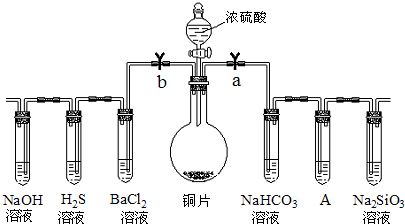
(1)验证碳、硅非金属性的相对强弱.(已知酸性:亚硫酸>碳酸)
①接仪器并检查装置气密性、加药品后,打开a关闭 b,然后滴入浓硫酸,加热.
②铜与浓硫酸反应的化学方程式是:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑.
装置A中的试剂可以是:品红溶液.
③能说明碳的非金属性比硅强的实验现象是:A中品红没有褪色,盛有Na2SiO3溶液的试管中出现白色沉淀.
(2)验证 SO2的氧化性、还原性和酸性氧化物的通性.
①打开b,关闭a.
②H2S溶液中有浅黄色浑浊出现,化学方程式是:2H2S+SO2=3S↓+2H2O
③BaCl2溶液中无明显现象,将其分成两份,分別滴加下列溶液,将产生的沉淀的化学式填人下表相应位置:
写出SO2与氯水反应的离子方程式Cl2+SO2+2H2O=SO42-+4H++2Cl-.

(1)验证碳、硅非金属性的相对强弱.(已知酸性:亚硫酸>碳酸)
①接仪器并检查装置气密性、加药品后,打开a关闭 b,然后滴入浓硫酸,加热.
②铜与浓硫酸反应的化学方程式是:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑.
装置A中的试剂可以是:品红溶液.
③能说明碳的非金属性比硅强的实验现象是:A中品红没有褪色,盛有Na2SiO3溶液的试管中出现白色沉淀.
(2)验证 SO2的氧化性、还原性和酸性氧化物的通性.
①打开b,关闭a.
②H2S溶液中有浅黄色浑浊出现,化学方程式是:2H2S+SO2=3S↓+2H2O
③BaCl2溶液中无明显现象,将其分成两份,分別滴加下列溶液,将产生的沉淀的化学式填人下表相应位置:
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 | BaSO4 | BaSO3 |
5.下列各组物质混合后,既产生无色气体,又生成白色沉淀的是( )
| A. | Ba(NO3)2溶液和Na2SO4溶液 | B. | 金属钠和MgCl2溶液 | ||
| C. | 金属铝和NaOH溶液 | D. | 盐酸和NaOH溶液 |
6.下列实验用来证明SO2的存在,其中正确的是( )
| A. | 能使品红褪色,加热后又出现红色 | |
| B. | 能使湿润的蓝色石蕊试纸变红 | |
| C. | 通入足量的NaOH溶液中,再滴入BaCl2溶液有白色沉淀生成,该沉淀溶于稀盐酸 | |
| D. | 通入稀溴水中能使溴水褪色,得澄清溶液,再滴加Ba(NO3)2溶液有白色沉淀生成,且该沉淀不溶于硝酸 |