��Ŀ����
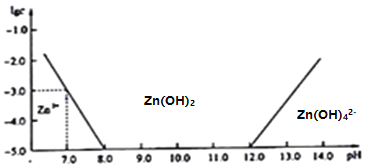
����Ŀ��������п������п������Ҫ�ĺ�п�����������п��������ˮ�İ�ɫ���壬��ˮ�еĵ�����ʽ��Al(OH)3���ơ������£�ˮ��Һ�в�ͬ��ʽ��п�����ʵ���Ũ��(����ֵlgc)��pH�Ĺ�ϵ����ͼ��ʾ���ش��������⣺
(1)��ZnCl2��Һ�еμ�NaOH��Һ��������������������___________________________��ʵ����������Zn��NaOH��Һ��ϡ�����Ʊ�Zn(OH)2����ѷ�����______________________��
(2)����ͼ�����ݿ�֪�������£�Ksp[Zn(OH)2]=_________��
(3)��ҵ�Ͽ�����п��(��Ҫ�ɷ���ZnCO3��������������Fe2O3��FeO��CuO������)Ϊԭ����ȡ����п�������������£�
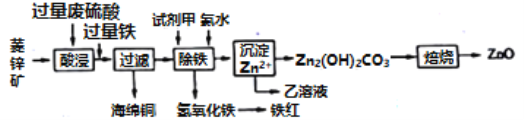
������п��__________(������������������������������)��������������У����Լ��������뷴Ӧ�����ӷ���ʽΪ______________________________________��
����������̼��п���氱ˮ��������Һ��pH���õ���������������ԭ����________����������Һ����c(Fe3+)Ϊ2.6��10-18mol/L����c(Zn2+)Ϊ______mol/L(��֪��Ksp[Fe(OH)3]=2.6��10-39)��
���𰸡� �Ȳ�����ɫ��������ɫ�������ܽ� ��Zn��Ϊ���ȷݣ��ֱ����NaOH��Һ�����ᣬʹ��ǡ���ܽ⣬Ȼ��������Һ��ϣ�����Zn(OH)2 1.0��10-17 ���� 2Fe2++H2O2+2H+=2Fe3++2H2O��2Fe2++H2O2+4NH3��H2O=2Fe(OH)3��+4NH4+ ZnCO3����H+��Ӧ��������ҺpH�����ã�ͬʱʹFe3+��ˮ��ƽ�������ƶ������������������� 1.0��10-3
����������1����ͼʾ�õ������������ӹ�����ʱ��������пӦ��ת��ΪZn(OH)42-�����Կ��������������а�ɫ�������ܽ����Ʊ�������п�Ĺ��̿��Բο������������Ʊ������Ƶõ�����Al3+��Al(OH)4-�ٷ���˫ˮ�ⷴӦ������������ȡ������п�ķ���Ϊ����Zn��Ϊ���ȷݣ��ֱ����NaOH��Һ�����ᣬʹ��ǡ���ܽ⣬Ȼ��������Һ��ϣ�����Zn(OH)2��
��2����ͼʾpH=7��ʱ��Zn2+Ϊ1��10-3mol/L������������п��KSP=1��10-3��(1��10-7)2=1.0��10-17��
��3���ٸ��ݣ�1���ķ�����������пӦ�������������������ZnO������������Լ��������ǽ�Fe2+����ΪFe3+��Ӧ��ʹ�ù���������������ɫ�����������Է���ʽΪ��2Fe2++H2O2+2H+=2Fe3++2H2O��
�ڼ���̼��п��������Һ�е������ӷ�Ӧ���������Һ��pH��ʹ��Һ�е�Fe3+ת��Ϊ��������������ȥ��ͬʱ���������ʡ�������Һ����c(Fe3+)Ϊ2.6��10-18mol/L����ΪKsp[Fe(OH)3]=2.6��10-39������c(OH-)=![]() mol/L������2���õ�������п��KSP=1.0��10-17������c(Zn2+)=1.0��10-17��(1.0��10-7)2=1.0��10-3��
mol/L������2���õ�������п��KSP=1.0��10-17������c(Zn2+)=1.0��10-17��(1.0��10-7)2=1.0��10-3��