题目内容
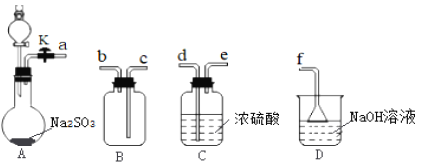
【题目】将如图中的K闭合,下列判断正确的是( )

A.去掉盐桥,此装置也能正常工作
B.盐桥中的K+向盛有硫酸铜溶液的烧杯移动,高锰酸根离子向b移动
C.一段时间后,硫酸铜溶液浓度减小
D.C极上的电极反应式为Fe3++e-=Fe2+
【答案】D
【解析】
原电池的构造原理要求装置能够形成闭合回路,盐桥在此使两个烧杯连接,形成闭合回路,据此分析;该原电池中Cu为负极,失电子形成铜离子,C为正极,铁离子得电子生成亚铁离子;因此b为电解池的负极,a为正极,电解池中阳离子向负极移动,阴离子向正极移动,据以上分析进行解答。
A、去掉盐桥,不能形成闭合回路,此装置不能正常工作,故A错误;
B、C极为原电池的正极,钾离子向盛有硫酸铁溶液的烧杯移动,a为电解池的阳极,高锰酸根离子向a移动,故B错误;
C、因为铜极发生氧化反应,极反应为Cu-2e-=Cu2+,所以溶液中铜离子浓度增大,故C错误;
D、C极为原电池正极,发生还原反应,极反应为Fe3++e-=Fe2+,故D正确;
故答案选D。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
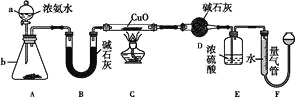
(1)仪器a的名称为____,仪器b中可选择的试剂为____。
(2)实验室中,利用装置A,还可制取的无色气体是____(填字母)。
A.Cl2 | B.O2 | C.CO2 | D.NO2 |
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体产生,上述现象证明NH3具有____性,写出相应的化学方程式:_______________________。
(4)E装置中浓硫酸的作用是_____________________________________。
(5)读取气体体积前,应对装置F进行的操作:____________________________。
(6)实验完毕,若测得干燥管D增重m g,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为____(用含m、n字母的代数式表示)。