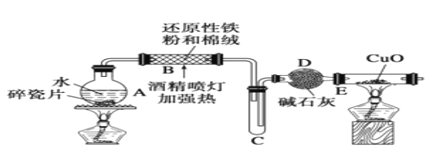
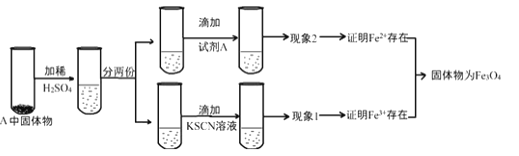
题目内容
【题目】在1L氯化铁和氯化铝的混合液中,Fe3+的物质的量浓度为0.4mol/L,Cl-的物质的量浓度为1.8 mol/L。要使Fe3+全部转化为沉淀分离出来,至少需要加入 4 mol/L NaOH溶液的体积为( )
A. 450mL B. 500mL C. 300mL D. 200mL
【答案】B
【解析】
根据氯化铁和AlCl3的混合溶液与碱的反应可知,要使Fe3+全部转化为沉淀分离出来,Al3+需要恰好转化为AlO2-,可以先利用电荷守恒来计算Al3+的浓度,再根据反应方程式计算。
FeCl3和AlCl3的混合溶液,其中Fe3+的物质的量浓度为0.4mol/L,Cl-的物质的量浓度为1.8mol/L,设Al3+的浓度为x,由电荷守恒可知,0.4mol/L×1L×3+x×1L×3=1.8mol/L×1L×1,解得x=0.2mol/L,则Fe3+、Al3+的物质的量分别为1L×0.4mol/L=0.4mol、1L×0.2mol/L=0.2mol,
FeCl3 + 3NaOH=Fe(OH)3↓+3NaCl
1 3
0.4mol 1.2mol
AlCl3 + 4NaOH=NaAlO2+3NaCl+2H2O,
1 4
0.2mol 0.8mol
使Fe3+全部转化为沉淀分离出来,消耗的NaOH的物质的量为1.2mol+0.8mol=2mol,则需加4molL-1NaOH溶液的体积为![]() =0.5L=500mL,故选B。
=0.5L=500mL,故选B。

练习册系列答案
相关题目