题目内容
【题目】氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)2NH3(g)△H.
(1)已知每破坏1mol有关化学键需要的能量如表:
H﹣H | N﹣H | N﹣N | N |
435.9KJ | 390.8KJ | 192.8KJ | 945.8KJ |
则△H= .
(2)在恒温、恒压容器中,氨体积比1:3加入N2和H2进行合成氨反应,达到平衡后,再向容器中充入适量氨气,达到新平衡时,c(H2)将(填“增大”“减小”或“不变”)
(3)在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(φ)如图所示. 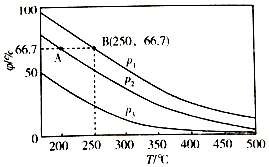
①其中,p1、p2和p3由大到小的顺序是 , 其原因是 .
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)vB(N2)(填“>”“<”或“=”)
③若在250℃、p1条件下,反应达到平衡时容器的体积为1L,则该条件下合成氨的平衡常数K=(保留一位小数).
(4)H2NCOONH4是工业由氨气合成尿素的中间产物.在一定温度下、体积不变的密闭容器中发生反应:H2NCOONH4(s)2NH3(g)+CO2(g),能说明该反应达到平衡状态的是(填序号). ①混合气体的压强不变
②混合气体的密度不变
③混合气体的总物质的量不变
④混合气体的平均相对分子质量不变
⑤NH3的体积分数不变.
【答案】
(1)﹣91.3KJ/mol
(2)不变
(3)p1>p2>p3;温度相同时,加压平衡正向移动,故压强越大平衡混合物中氨的体积分数越大;<;5925.9L2/mol2
(4)①②③
【解析】解:(1)N2 (g)+3H2 (g)2NH3(g)△H=反应物键能和﹣生成物键能和=945.8KJ/mol+3×435.9KJ/mol﹣6×390.8KJ/mol=﹣91.3KJ/mol, 所以答案是:﹣91.3KJ/mol;(2)保持恒温恒压,达到平衡后,再向容器中充入适量氨气,在恒压条件下与原平衡状态相同,为等效平衡,平衡时两种情况平衡状态相同,各物质的含量不变,所以达到新平衡时,c(H2)将不变,所以答案是:不变;(3)①由N2+3H22NH3可知,增大压强,平衡正向移动,由图象可知在相同温度下,平衡后混合物中氨的体积分数(φ)为P1>P2>P3 , 因此压强关系是P1>P2>P3 , 所以答案是:p1>p2>p3;温度相同时,加压平衡正向移动,故压强越大平衡混合物中氨的体积分数越大;②温度越大,压强越大,反应速率越大,p1>p2 , 由图可知,B对应的温度、压强大,则反应速率大,
所以答案是:<;③
N2+ | 3H2 | 2NH3 | |
起始 | 0.1 | 0.3 | 0 |
转化 | x | 3x | 2x |
平衡 | 0.1-x | 0.3-3x | 2x |
![]() =0.667,x=0.08
=0.667,x=0.08
K= ![]() =
= ![]() =5925.9L2/mol2 ,
=5925.9L2/mol2 ,
所以答案是:5925.9L2/mol2;(4)H2NCOONH4(s)2NH3(g)+CO2(g),
①该反应为气体体积增大的反应,反应过程中压强逐渐增大,当压强不变时,表明正逆反应速率相等,该反应达到平衡状态,故①正确;②由于H2NCOONH4是固体,没有达到平衡状态前,气体质量会变化,容器体积不变,密度也会发生变化,所以密度不变,达到了平衡状态,故②正确;③由于H2NCOONH4是固体,生成物全部为气体,气体的物质的量在增加,当混合气体的总物质的量不变,说明正逆反应速率相等,达到了平衡状态,故③正确;④混合气体的平均相对分子质量= ![]() ,混合气体的质量恒等于H2NCOONH4(s)分解的质量,气体的物质的量为分解的H2NCOONH4(s)的三倍,混合气体的平均相对分子质量不变恒不变,不能说明反应达到平衡状态,故④错误;
,混合气体的质量恒等于H2NCOONH4(s)分解的质量,气体的物质的量为分解的H2NCOONH4(s)的三倍,混合气体的平均相对分子质量不变恒不变,不能说明反应达到平衡状态,故④错误;
⑤因反应物(NH2COONH4)是固体物质,所以密闭容器中NH3的体积分数始终不变,故⑤错误;所以答案是:①②③.
【考点精析】认真审题,首先需要了解反应热和焓变(在化学反应中放出或吸收的热量,通常叫反应热),还要掌握化学平衡状态本质及特征(化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效))的相关知识才是答题的关键.

 名校课堂系列答案
名校课堂系列答案