��Ŀ����
����Ŀ��ѧϰ��ѧӦ��ȷ����������������������ȥ���ĵ�������ش��������⣺
��1��Ư�۾�����Ч�ɷֵĻ�ѧʽΪ__________________��
��2��������ϡ������ǽ������ϵ����ǣ����й㷺Ӧ���ڹ��ά�IJ�����_________��
��3������ǵ�ˮ�м�������KAl��SO4��212H2O��ˮ�ɵõ�������д��������ˮ�еĵ��뷽��ʽ__________________����������Һ����μ���Ba��OH��2��Һֱ��Al3+ǡ�ó�����ȫ��������Ӧ�����ӷ���ʽΪ__________________��
��4������ˮ�е�NO3-�����ཡ������Σ����Ϊ�˽�������ˮ��NO3-��Ũ�ȣ������ڼ��������������۽�NO3-��ԭΪN2���仯ѧ����ʽΪ��
10Al+6NaNO3+4NaOH�T10NaAlO2+3N2��+2H2O��
��ش��������⣺
���ڻ�ѧ����ʽ���õ����ű���÷�Ӧ�е���ת�Ƶķ������Ŀ��_______________
��������Ӧ�������ɱ����3.36LN2����ת�Ƶĵ�����ĿΪ______________��
���𰸡� Ca(ClO)2 SiO2 KAl(SO4)2=K++Al3++2SO42- 2Al3++3Ba2++6OH-+3SO42-=2Al(OH)3��+3BaSO4�� 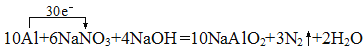 1.5NA
1.5NA
����������1��Ư������Cl2��Ca(OH)2��Ӧ�Ƶõģ�����Ҫ�ɷ���CaCl2��Ca(ClO)2����Ч�ɷ���Ca(ClO)2����ȷ�𰸣�Ca(ClO)2����2�����ά��Ҫ�ɷ���SiO2����ȷ�𰸣�SiO2����3��������ˮ�е���õ�Al3+��K +��SO42-�����뷽��ʽΪKAl(SO4)2=K++Al3++2SO42-������Ba(OH)2��Al3+ǡ����ȫ����ʱ����KAl(SO 4)2Ϊ1mol����ҪOH- 3mol����Ba2+Ϊ1.5mol������BaSO41.5mol����Һ�л���0.5molSO42-û�вμӷ�Ӧ����Ӧ���ӷ���ʽΪ2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3��+3BaSO4�� ��ȷ�𰸣�KAl(SO4)2=K++Al3++2SO42-��2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3��+3BaSO4������4���÷�Ӧ��AlԪ�ش�0�����ߵ�+3�ۣ�ʧȥ��������3��10=30��NaNO3��+5��NԪ�ػ��ϼ۽��͵�0������N2��![]() ����3N2��30e-�����Ե�N2Ϊ3.36L/22.4L��mol-1=0.15molʱ��ת�Ƶ�����Ϊ1.5mol����ȷ�𰸣�
����3N2��30e-�����Ե�N2Ϊ3.36L/22.4L��mol-1=0.15molʱ��ת�Ƶ�����Ϊ1.5mol����ȷ�𰸣�![]() ��1.5mol��
��1.5mol��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ�����Ĺ̶�һֱ�ǿ�ѧ���о�����Ҫ���⣬�ϳɰ������˹��̵��Ƚϳ���ļ�������ԭ��ΪN2 ��g��+3H2 ��g��2NH3��g����H��
��1����֪ÿ�ƻ�1mol�йػ�ѧ����Ҫ�����������
H��H | N��H | N��N | N |
435.9KJ | 390.8KJ | 192.8KJ | 945.8KJ |
���H= ��
��2���ں��¡���ѹ�����У��������1��3����N2��H2���кϳɰ���Ӧ���ﵽƽ������������г��������������ﵽ��ƽ��ʱ��c��H2�������������С�����䡱��
��3���ڲ�ͬ�¶ȡ�ѹǿ����ͬ���������£���ʼʱN2��H2�ֱ�Ϊ0.1mol��0.3molʱ��ƽ��������а�������������գ���ͼ��ʾ�� 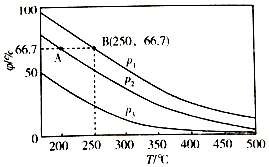
�����У�p1��p2��p3�ɴ�С��˳���� �� ��ԭ���� ��
�����ֱ���vA��N2����vB��N2����ʾ�ӷ�Ӧ��ʼ����ƽ��״̬A��Bʱ�Ļ�ѧ��Ӧ���ʣ���vA��N2��vB��N2�����������������=����
������250�桢p1�����£���Ӧ�ﵽƽ��ʱ���������Ϊ1L����������ºϳɰ���ƽ�ⳣ��K=������һλС������
��4��H2NCOONH4�ǹ�ҵ�ɰ����ϳ����ص��м�����һ���¶��¡����������ܱ������з�����Ӧ��H2NCOONH4��s��2NH3��g��+CO2��g������˵���÷�Ӧ�ﵽƽ��״̬����������ţ��� �ٻ�������ѹǿ����
�ڻ��������ܶȲ���
�ۻ������������ʵ�������
�ܻ�������ƽ����Է�����������
��NH3������������䣮