题目内容
【题目】石英砂岩,是硅石中的一种,其主要化学成分可简单表示为MgAl4Si10O26(OH)2(假设杂质均能溶于硫酸),工业上拟用该物质为原料制备高纯度硅,其艺流程如图所示:
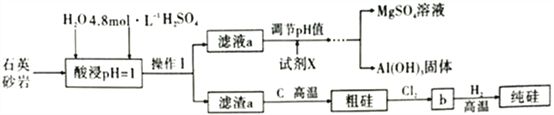
(1)请将石英砂岩的组成用氧化物的形式表示:________________,酸浸时,为了提高浸取率可采取的措施有______________________________________。(答出两点)
(2)实验室用18.4mol·L-1的浓硫酸配制250mL4.8mol·L-1的硫酸,需量取浓硫酸_______mL(结果保留一位小数);配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需__________________________。
(3)制备高纯硅的过程中需要用到Cl2,请写出实验室制备Cl2的离子反应方程式:______________。
(4)请写出b和H2反应的化学方程式,并用单线桥法表示该反应过程中电子的转移:_______________。
(5)通过实验测得滤液a中c(Al3+)=1.0mol·L-1,c(Mg2+)=0.28mol·L-1,某同学打算通过调节溶液的pH值使Al3+和Mg2+完全分离(当离子浓度降到1.0×10-6mol·L-1时即视为完全分离),则试剂X用_______(填“0.1mol·L-1NaOH或“0.1mol·L-1氨水”)较好;沉淀时应控制溶液的pH值的取值范围为_______(已知:KspAl(OH)3=8.0×10-33,Ksp[Mg(OH)2]=2.8×10-11,lg2=0.3,lg5=0.7)。
【答案】 .MgO·2Al2O3·10SiO2·H2O 加热或适当增大H+的浓度或将矿石粉碎 65.2 250mL容量瓶、胶头滴管 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O 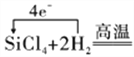 Si+4HCl 0.1mol·L-1氨水 [5.3,9.0)
Si+4HCl 0.1mol·L-1氨水 [5.3,9.0)
【解析】(1)MgAl4Si10O26(OH)2用氧化物的形式表示为MgO·2Al2O3·10SiO2·H2O,酸浸时,为了提高浸取率,可以改变适当的条件,采取的措施通常有加热或适当增大H+的浓度或将矿石粉碎,故答案为:MgO·2Al2O3·10SiO2·H2O;加热或适当增大H+的浓度或将矿石粉碎;
(2)根据稀释后硫酸的物质的量不变,需量取浓硫酸的体积=![]() =0.0652L=65.2 mL,配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需250mL容量瓶、胶头滴管,故答案为:65.2;250mL容量瓶、胶头滴管;
=0.0652L=65.2 mL,配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需250mL容量瓶、胶头滴管,故答案为:65.2;250mL容量瓶、胶头滴管;
(3)实验室通常用浓盐酸与二氧化锰加热制备Cl2,反应的离子反应方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(4)根据流程图,粗硅与氯气反应生成四氯化硅,四氯化硅和H2反应生成硅和氯化氢,反应的化学方程式为SiCl4 + 2H2![]() 4HCl + Si,反应过程中电子的转移用单线桥法表示为
4HCl + Si,反应过程中电子的转移用单线桥法表示为![]() Si+4HCl,故答案为:
Si+4HCl,故答案为:![]() Si+4HCl;
Si+4HCl;
(5)由于氢氧化铝是两性氢氧化物,能够溶于过量的氢氧化钠溶液,因此选用0.1mol·L-1氨水较为合理;当开始沉淀Mg2+时,c(OH-)= =
=![]() =
=![]() =1.0×10-5mol·L-1,pH=9.0,当完全沉淀Mg2+时,c(OH-)=
=1.0×10-5mol·L-1,pH=9.0,当完全沉淀Mg2+时,c(OH-)=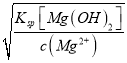 =
=![]() =
=![]() =
=![]() ×10-3mol·L-1,pH在11~12之间,当开始沉淀Al3+时,c(OH-)=
×10-3mol·L-1,pH在11~12之间,当开始沉淀Al3+时,c(OH-)=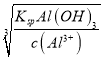 =
==2.0×10-11mol·L-1,pH=3.3,当完全沉淀Al3+时,c(OH-)=
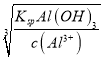 =
=![]() =2.0×10-9mol·L-1,pH=5.3,因此调节溶液的pH值使Al3+和Mg2+完全分离,需要控制溶液的pH值在[5.3,9.0) ,故答案为:0.1mol·L-1氨水;[5.3,9.0)。
=2.0×10-9mol·L-1,pH=5.3,因此调节溶液的pH值使Al3+和Mg2+完全分离,需要控制溶液的pH值在[5.3,9.0) ,故答案为:0.1mol·L-1氨水;[5.3,9.0)。

