题目内容
4.焦亚硫酸钠(Na2S2O5)在食品加工中常用作防腐剂、漂白剂和疏松剂.焦亚硫酸钠为黄色结晶粉末,150℃时开始分解,在水溶液或含有结晶水时更易被空气氧化.实验室制备焦亚硫酸钠过程中依次包含以下几步反应:2NaOH+SO2═Na2SO3+H2O …(a)
Na2SO3+H2O+SO2═2NaHSO3…(b)
2NaHSO3$\frac{\underline{\;\;△\;\;}}{\;}$ Na2S2O5+H2O …(c)
实验装置如下:
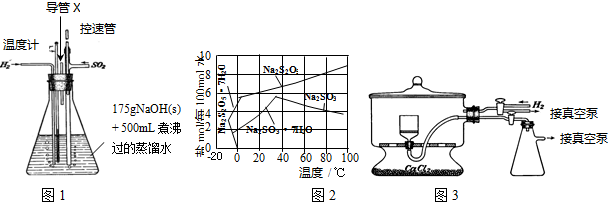
(1)实验室可用废铝丝与NaOH溶液反应制取H2,制取H2的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)如图1装置中,导管X的作用是排出H2、未反应的SO2及水蒸气等.
(3)通氢气一段时间后,以恒定速率通入SO2,开始的一段时间溶液温度迅速升高,随后温度缓慢变化,溶液开始逐渐变黄.“温度迅速升高”的原因为SO2与NaOH溶液的反应是放热反应;实验后期须保持温度在约80℃,可采用的加热方式为80℃水浴加热.
(4)反应后的体系中有少量白色亚硫酸钠析出,参照题如图2溶解度曲线,除去其中亚硫酸钠固体的方法是趁热过滤;然后获得较纯的无水Na2S2O5应将溶液冷却到30℃左右抽滤,控制“30℃左右”的理由是此时溶液中Na2SO3不饱和,不析出.
(5)用如图3装置干燥Na2S2O5晶体时,通入H2的目的是排出空气,防止焦亚硫酸钠被氧化;真空干燥的优点是干燥室内部的压力低,水分在低温下就能气化,减少产品氧化.
(6)测定产品中焦亚硫酸钠的质量分数常用剩余碘量法.已知:S2O52-+2I2+3H2O═2SO42-+4I-+6H+;2S2O32-+I2═S4O62-+2I-
请补充实验步骤(可提供的试剂有:焦亚硫酸钠样品、标准碘溶液、淀粉溶液、酚酞溶液、标准Na2S2O3溶液及蒸馏水).
①精确称取产品0.2000g放入碘量瓶(带磨口塞的锥形瓶)中.
②准确移取一定体积和已知浓度的标准碘溶液(过量)并记录数据,在暗处放置5min,然后加入5mL冰醋酸及适量的蒸馏水.
③用标准Na2S2O3溶液滴定至接近终点.
④加入1~2mL淀粉溶液.
⑤继续用标准Na2S2O3溶液滴定至蓝色刚好褪去且半分钟内颜色不复现,记录滴定所消耗的体积.
⑥重复步骤①~⑤;根据相关记录数据计算出平均值.
分析 (1)铝和NaOH溶液反应生成偏铝酸钠和氢气;
(2)该装置中二氧化硫和氢氧化钠发生反应,通入氢气能防止亚硫酸盐被氧化,如果锥形瓶内压强过大会产生安全事故;
(3)SO2与NaOH溶液的反应是放热反应导致溶液温度升高;温度小于100℃时要采用水浴加热;
(4)根据图知,温度越高Na2S2O5溶解度增大,当接近40℃时亚硫酸钠溶解度减小;控制“30℃左右”时,此时溶液中Na2SO3不饱和;
(5)焦亚硫酸钠能被压强氧化;真空干燥时,干燥室内部的压力低,水分在低温下就能气化;
(6)④碘能使淀粉变蓝色,所以可以用淀粉试液检验滴定终点;
⑤继续做实验为:继续用标准Na2S2O3溶液滴定至蓝色刚好褪去且半分钟内颜色不复现,记录滴定所消耗的体积.
解答 解:(1)铝和NaOH溶液反应生成偏铝酸钠和氢气,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)该装置中二氧化硫和氢氧化钠发生反应,通入氢气能防止亚硫酸盐被氧化,如果锥形瓶内压强过大会产生安全事故,所以导管的作用是排出H2、未反应的SO2及水蒸气等,从而防止安全事故的发生,故答案为:排出H2、未反应的SO2及水蒸气等;
(3)SO2与NaOH溶液的反应是放热反应导致溶液温度升高,所以溶液“温度迅速升高”;温度小于100℃时要采用水浴加热,需要的温度是80℃,所以用水浴加热;
故答案为:SO2与NaOH溶液的反应是放热反应;80℃水浴加热;
(4)根据图知,温度越高Na2S2O5溶解度增大,当接近40℃时亚硫酸钠溶解度减小,所以要趁热过滤;控制“30℃左右”时,此时溶液中Na2SO3不饱和,不析出,
故答案为:趁热过滤;此时溶液中Na2SO3不饱和,不析出;
(5)焦亚硫酸钠能被压强氧化,则通入氢气的目的是排出空气,防止焦亚硫酸钠被氧化;真空干燥时,干燥室内部的压力低,水分在低温下就能气化,从而减少产品氧化,
故答案为:排出空气,防止焦亚硫酸钠被氧化;干燥室内部的压力低,水分在低温下就能气化,减少产品氧化;
(6)④碘能使淀粉变蓝色,所以可以用淀粉试液检验滴定终点,需要的操作是加入1~2mL淀粉溶液,故答案为:加入1~2mL淀粉溶液;
⑤继续做实验为:继续用标准Na2S2O3溶液滴定至蓝色刚好褪去且半分钟内颜色不复现,记录滴定所消耗的体积,然后再重复实验,减少实验误差,故答案为:继续用标准Na2S2O3溶液滴定至蓝色刚好褪去且半分钟内颜色不复现,记录滴定所消耗的体积.
点评 本题考查制备实验方案设计,为高频考点,明确实验原理及物质性质是解本题关键,侧重考查学生实验操作、实验评价、物质制备能力,知道各个仪器的作用,题目难度中等.


| A. | 分子式为C2H4O的有机化合物性质相同 | |
| B. | 同温同压下,同体积的任何气体均含有相同的原子数 | |
| C. | 密闭容器中1molN2与3molH2充分反应,产物的分子数为 2×6.02×1023 | |
| D. | 依据上图能量曲线可确定反应:CH2=CH2(g)+HBr(g)→CH3CH2Br(l)的△H=(E1+E3-E2-E4)kJ•mol-1 |
| 选项 | W | X | Y | Z |  |
| A | N2 | NH3 | NO | NO2 | |
| B | Na | Na2O2 | NaOH | Na2CO3 | |
| CC | Cu | CuSO4 | CuCl2 | Cu(OH)2 | |
| D | Al | Al2(SO4)3 | AlCl3 | NaAlO2 |
| A. | A | B. | B | C. | C | D. | D |
 700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
| 反应时间/min | n(CO)/mol | n (H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.20 | |
| t2 | 0.80 |
(1)反应在t1min内的平均速率为v(H2)=$\frac{0.20}{{t}_{1}}$mol•L-1•min-1
(2)保持其他条件不变,起始时向容器中充入0.60molCO和1.20molH2O,到达平衡时,n(CO2)=0.4mol.
(3)温度升至800℃,上述反应平衡常数为0.64,则正反应为放热反应(填“放热”或“吸热”).
(4)700℃时,向容积为2L的密闭容器中充入CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为1.20mol、2.00mol、1.20mol、1.20mol,则此时该反应v(正)>v(逆)(填“>”、“<”或“=”).
(5)该反应在t1时刻达到平衡、在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件是降低温度、增加水蒸汽的量或减少氢气的量(写出两种).
(6)若该容器绝热体积不变,不能判断反应达到平衡的是②③.
①体系的压强不再发生变化
②混合气体的密度不变
③混合气体的平均相对分子质量不变④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化⑥v(CO2)正=v(H2O)逆.
| A. | 吸热、熵增的非自发反应在一定条件下也可能变为自发进行的反应 | |
| B. | 自发反应一定是能发生的反应,非自发反应有可能是能发生的反应 | |
| C. | 凡是放热反应都是自发的,吸热反应都是非自发的 | |
| D. | 放热、熵增的自发反应在一定的条件下也可能转变为非自发过程 |

 .
.