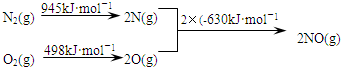题目内容
18.下列化学用语正确的是( )| A. | 氯化钙的化学式:CaCl | |
| B. | 镁离子结构示意图: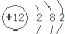 | |
| C. | 碳酸钠的电离方程式:Na2CO3═Na++CO32- | |
| D. | 氢氧化钡的电离方程式Ba(OH)2═Ba2++2OH- |
分析 A.化学式是元素符号和小数字组成的表示物质组成的式子,氯化钙中钙为+2价,氯为-1价;
B.镁离子为阳离子,为镁原子失去最外层2个电子形成;
C.电离方程式左右电荷不守恒;
D.氢氧化钡为二元强碱,完全电离出钡离子和氢氧根离子.
解答 解:A.氯化钙中钙为+2价,氯为-1价,化学式为CaCl2,故A错误;
B.镁原子序数为12的元素,质子数为12,镁离子核外电子数为10,有2个电子层,最外层有8个电子,离子结构示意图为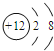 ,故B错误;
,故B错误;
C.碳酸钠的电离方程式为:Na2CO3═2Na++CO32-,故C错误;
D.氢氧化钡为二元强碱,完全电离:Ba(OH)2═Ba2++2OH-,故D正确;
故选D.
点评 本题考查了化学式、离子结构示意图、电离方程式的表示方法判断,题目难度不大,注意掌握常见化学用语的表示方法,明确电离方程式的书写原则.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
6.假定把12C的相对原子质量定为24,把24g12C含有的原子个数定为阿伏加德罗常数,而物质的量的概念不变.则下列推断不正确的是( )
| A. | 此时16O的相对原子质量为32 | |
| B. | 40gNaOH溶于水配成1L溶液,其物质的量浓度为1 mol/L | |
| C. | 标况下44gCO2的体积为22.4L | |
| D. | NA个氧分子与NA个氢分子有相同数目的分子 |
13.Ba(OH)2(固体)、CuSO4(固体)、CH3COOH(液态)这些物质为什么归为一类,下列哪些物质还可以和它们归为一类( )
| A. | 75%的酒精溶液 | B. | HCl(气态) | C. | Fe (OH)3胶体 | D. | 豆浆 |
10.下表是元素周期表的一部分,表中序号分别代表某一元素.请回答下列问题.
(1)①~⑩中,金属性最强的元素是Na(写元素符号,下同);非金属性最强的元素是F;形成化合物种类最多的元素是C;某元素的气态氢化物与其最高价氧化物的水化物可直接化合生成一种盐,该元素是N.
(2)③、③、⑤,其原子半径由大到小的顺序是Na>N>F(写元素符号).
(3)⑧、⑨的氢化物,还原性更强的是H2S(填化学式).
(4)①~⑨的最高价氧化物的水化物中:酸性最强的是HClO4(填化学式);碱性最强的是NaOH(填化学式),它的水溶液与⑦的最高价氧化物的水化物反应的离子离子方程式为OH-+Al(OH)3=AlO2-+2H2O.
| 周期/族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅧA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)③、③、⑤,其原子半径由大到小的顺序是Na>N>F(写元素符号).
(3)⑧、⑨的氢化物,还原性更强的是H2S(填化学式).
(4)①~⑨的最高价氧化物的水化物中:酸性最强的是HClO4(填化学式);碱性最强的是NaOH(填化学式),它的水溶液与⑦的最高价氧化物的水化物反应的离子离子方程式为OH-+Al(OH)3=AlO2-+2H2O.
8.在0.1mol/L CH3COOH溶液中存在如下电离平衡:CH3COOH?CH3COO-+H+,对于该平衡,下列叙述不正确的是( )
| A. | 加入水时,平衡向正反应方向移动,溶液中n(H+)增大 | |
| B. | 加入少量冰醋酸,平衡向正反应方向移动,溶液中c(H+)增大 | |
| C. | 加入少量0.1 mol•L-1 HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减小 | |
| D. | 加入少量CH3COONa固体,平衡向逆反应方向移动,溶液中c(H+)减小 |
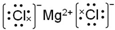 .
.